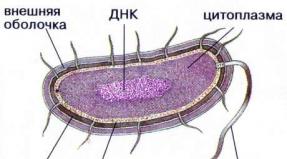
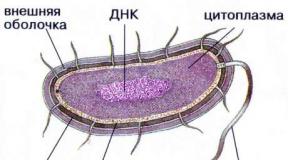
Definicja jonu w fizyce. Jony to atomy posiadające ładunek. Reakcje jonowe w roztworze
JON
(od greckiego jonu - chodzenie), ładowanie elektrycznie. cząstki powstałe podczas utraty lub dodawania elektronów przez atomy, cząsteczki, rodniki itp. I. mogą zatem być dodatnie (wraz z utratą elektronów) i ujemne (w przypadku dodania elektronów), I. jest wielokrotnością ładunku elektron włączony. I. może być częścią cząsteczek i występować w stanie niezwiązanym (w gazach, cieczach, plazmie).
Fizyczny słownik encyklopedyczny. - M .: Encyklopedia radziecka. . 1983 .
JON (od greckiego jon - dzieje) to elektrycznie naładowana cząstka utworzona w wyniku oddzielenia lub przyłączenia jednego lub więcej. elektrony (lub inne naładowane cząstki) do atomu, cząsteczki, rodnika lub innego jonu. Dodatnio naładowane I. nazywane są. kationy, naładowane ujemnie - aniony itp. I. oznaczają substancję chemiczną. symbol ze indeksem (w prawym górnym rogu) wskazujący znak i wielkość ładunku - krotność I. - w jednostkach ładunku elektronu (na przykład Li +, H 2 +, SO 4 2-). Atomic I. oznacza także substancję chemiczną. symbol elementu z cyframi rzymskimi wskazującymi krotność I. (na przykład NI, NII, NIII, co odpowiada N, N +, N 2+; w tym przypadku cyfry rzymskie są symbolami spektroskopowymi Z , są one większe od ładunku jonu Z i o jeden: Z = Z i + l). Sekwencja I. różne substancje chemiczne. tworzą się pierwiastki zawierające tę samą liczbę elektronów (patrz np. atomy wodoru). Pojęcie i termin „ja”. (a także „” i „anion”) zostały wprowadzone w 1834 roku przez M. Faradaya. Aby usunąć elektron z neutralnego atomu lub konieczne jest wydanie określonej kwoty. energii, tzw energia jonizacji. Nazywa się energią jonizacji na ładunek elektronu potencjał jonizacyjny. Charakterystyka przeciwna energii jonizacji - - jest równa energii wiązania dopełniacza, elektronu w pozycji ujemnej. I. Atomy neutralne ulegają jonizacji pod wpływem kwantów optycznych. promieniowanie, rentgen i promieniowanie g, elektryczne. pola podczas zderzeń z innymi atomami, elektronami i innymi cząstkami itp. cząsteczka DNA niosąca ujemnie naładowaną grupę fosforanową PO 4 - w każdej ze swoich powtarzających się jednostek. Niektóre cząsteczki znajdujące się w roztworach i kryształach pozostają ogólnie elektrycznie obojętne, chociaż ulegają rozkładowi. na jego obszarach znajdują się grupy o przeciwnym ładunku, nazywa się je. jony obojnacze. Zatem cząsteczka aminokwasu H 2 N - CHP-COOH (P jest rodnikiem bocznym) przekształca się w postać obojnaczą H 3 N-CHP-COO -, czemu towarzyszy przeniesienie protonu z grupy COOH do H Grupa 2 N. Kompleks składający się z kilku. neutralne atomy lub cząsteczki i proste I. tworzy kompleks I., tzw. jon klastra. W gazach w normalnych warunkach powstające jony są krótkotrwałe, jednak w wysokich temperaturach i ciśnieniach stopień jonizacji gazu wzrasta wraz ze wzrostem temperatury i ciśnienia, a przy bardzo wysokich temperaturach i ciśnieniach gaz zamienia się w osocze. W cieczach, w zależności od charakteru rozpuszczalnika i substancji rozpuszczonej, kationy i aniony mogą znajdować się w niemal nieskończonej odległości od siebie (w przypadku, gdy są otoczone cząsteczkami rozpuszczalnika), ale mogą też znajdować się dość blisko siebie i silnie oddziałując tworzą tzw pary jonowe. Zwykle tworzą się sole stałe kryształy jonowe. Energię interakcji cząstek atomowych w funkcji odległości między nimi można obliczyć za pomocą rozkładu. metody przybliżone (patrz interakcja międzycząsteczkowa). Poziomy energii jonizacji atomowej i molekularnej oraz cząstek obojętnych są różne i w zasadzie można je obliczyć metodami mechaniki kwantowej, a także energie jonizacji. Optyczny Widma energii atomowej są podobne do widm neutralnych atomów o tej samej liczbie elektronów; są one przesunięte jedynie w zakresie fal krótkich, ponieważ długości linii widmowych odpowiadają przejściom kwantowym pomiędzy poziomami energii o różnych wartościach z rozdz. liczby kwantowe są proporcjonalne do kwadratu ładunku jądrowego. W widmach I. tzw linie satelitarne, których analiza pozwala na poznanie struktury i właściwości zwielokrotniać naładowane jony. Składnik jonowy ma istotny wpływ na parametry plazmy laboratoryjnej i astrofizycznej. Badanie energii jest ważne dla różnych dziedzin fizyki i chemii plazmy, astrofizyki, elektroniki kwantowej, badania struktury substancji itp. Energia jest szeroko stosowana w eksperymentach. badania i instrumenty (spektrometry mas, komory Wilsona, projektor jonowy, wiązki jonów itp.). Oświetlony.: Smirnov B. M., Jony ujemne, M., 1978; Presnyakov L.P., Shevelko V.P., Yanev R.K., Elementarny z udziałem wielokrotnie naładowanych jonów, M., 1986. V.G. Daszewski.
Encyklopedia fizyczna. W 5 tomach. - M .: Encyklopedia radziecka. Redaktor Naczelny A. M. Prochorow. 1988 .
Synonimy:
Zobacz, co „ION” znajduje się w innych słownikach:
Termin ten ma inne znaczenia, patrz Ion (znaczenia). Typ „ION” Firma prywatna… Wikipedia
jon- Atom lub grupa atomów, która w wyniku utraty lub zyskania jednego lub większej liczby elektronów nabyła ładunek elektryczny. Jeśli jon pochodzi od atomu wodoru lub atomu metalu, jest zwykle naładowany dodatnio; jeśli jon pochodzi z atomu niemetalu... ... Przewodnik tłumacza technicznego
Ach, mąż. Razg. do (patrz Jonasz). Raport: Ionovich, Ionovna; rozkład Ionych. Słownik imion osobowych. Ion Zobacz Yvona. Dzień Anioła. Przewodnik po imionach i urodzinach. 2010… Słownik imion osobowych
- (Ion, Ιων). Syn Xuthusa, przodek plemienia jońskiego. (Źródło: „Krótki słownik mitologii i starożytności”. M. Korsh. Sankt Petersburg, opublikowane przez A. S. Suvorina, 1894.) ION (Ίων), w mitologii greckiej król ateński, syn Kreuzy. Ojciec I. najbardziej... Encyklopedia mitologii
ION, twój mąż. harmonia, sens, znaczenie, przydatność. Jest niezdarny, nie ma w nim jonu. Okno nie zostało przecięte do jonu, więc je uszczelniłem. Słownik wyjaśniający Dahla. VI.I. Dahla. 1863 1866… Słownik wyjaśniający Dahla
Istnieje., liczba synonimów: 17 dodatek (1) amfion (2) anion (1) ... Słownik synonimów
Atom (lub grupa atomów, jon złożony), który przenosi dodatni (kation) lub ujemny (anion) ładunek elektryczny i jest niezależnym lub stosunkowo niezależnym składnikiem (jednostką budulcową) substancji lub... ... Encyklopedia geologiczna
Ion, Ion, z Chios, ok. 490 ok. 421 PRZED CHRYSTUSEM e., grecki poeta. Często odwiedzał Ateny, choć nie osiadł tam na zawsze. Utrzymywał przyjazne stosunki z Tymonem i Temistoklesem, znał także Ajschylosa i Sofoklesa. Pierwszą tragedię wystawił w 451 roku. Dla nas... ... Starożytni pisarze
W mitologii greckiej wnuk Hellenesa, syn Xuthusa (lub Apolla); przodek plemienia jońskiego. Został królem Aten; jego synowie Hopleth, Helenont, Egikorei, Argad są eponimami czterech najstarszych typów Attyki... Wielki słownik encyklopedyczny
- (Ain) (prawdopodobnie ruiny), miasto i równina położone na północy. źródło Jordanu (1 Król. 15:20; 2 Król. 15:29). I. został podbity przez Arama. (Sir.) przez króla Benhadada, a później przez Tiglata-Pilesera III (bib. Feglat-Pilesera). W 1 Królów 15:20 nazwy miejsc wymienione są w... ... Encyklopedia biblijna Brockhausa
Książki
- Ion Creanga. Wybrane prace. Wspomnienia z dzieciństwa. Bajki. Historie, Ion Creangă. Bukareszt, 1959. Wydawnictwo na języki obce. Z ilustracjami. Oprawa wydawcy. Stan jest dobry. Klasyk literatury rumuńskiej i mołdawskiej Ion Creangă (1837-1889) w swoim…
JONY JONY to elektrycznie naładowane cząstki powstałe z atomu (cząsteczki) w wyniku utraty lub zyskania jednego lub większej liczby elektronów. Dodatnio naładowane jony nazywane są kationami, ujemnie naładowane jony nazywane są anionami.
Nowoczesna encyklopedia. 2000 .
Zobacz, jakie „IONS” znajdują się w innych słownikach:
JONY- (od greckiego chodzenia jonowego, wędrówki), atomy lub substancja chemiczna. rodniki przenoszące ładunki elektryczne. Historia. Jak po raz pierwszy ustalił Faradaya, przewodzenie prądu elektrycznego w roztworach jest związane z ruchem cząstek materialnych przenoszących... ... Wielka encyklopedia medyczna
jony- – elektrycznie naładowane atomy lub cząsteczki. Chemia ogólna: podręcznik / A. V. Zholnin Jony to elektrycznie naładowane cząstki, które powstają, gdy atomy, cząsteczki i rodniki tracą lub zyskują elektrony. Słownik chemii analitycznej... ... Terminy chemiczne
Produkty rozkładu dowolnego ciała poprzez elektrolizę. Słownik obce słowa, zawarte w języku rosyjskim. Chudinov A.N., 1910 ... Słownik obcych słów języka rosyjskiego
- (od greckiego iōn dzieje), naładowane cząstki powstałe z atomu (cząsteczki) w wyniku utraty lub zyskania jednego lub większej liczby elektronów. W roztworach jony naładowane dodatnio nazywane są kationami, jony naładowane ujemnie ... ... Słownik encyklopedyczny
Jon (gr. ιόν „idzie”) to elektrycznie naładowana cząstka (atom, cząsteczka), zwykle powstająca w wyniku utraty lub zyskania jednego lub większej liczby elektronów przez atomy lub cząsteczki. Ładunek jonu jest wielokrotnością ładunku elektronu. Koncepcja i... ... Wikipedia
Jony- (od greckiego słowa „jon”) cząstki naładowane elektrycznie utworzone w wyniku utraty lub zyskania elektronów (lub innych naładowanych cząstek) przez atomy lub grupy atomów (cząsteczki, rodniki itp.). Pojęcie i termin jony zostały wprowadzone w 1834 roku... ... Encyklopedyczny słownik metalurgii
- (z języka greckiego): cząstki jednoatomowe lub wieloatomowe przenoszące elektryczność. naładować, np. H+, Li+, Al3+, NH4+, F, SO42. Dodatnie I. nazywane są kationami (od greckiego kation, dosłownie schodzące w dół), anionem ujemnym i m (od greckiego anionu, ... ... Encyklopedia chemiczna
- (od greckiego ión dzieje) cząstki naładowane elektrycznie utworzone w wyniku utraty lub zyskania elektronów (lub innych naładowanych cząstek) przez atomy lub grupy atomów. Takimi grupami atomów mogą być cząsteczki, rodniki lub inne... Wielka encyklopedia radziecka
jony- fizyczne cząstki przenoszące ładunek dodatni lub ujemny. Jony naładowane dodatnio przenoszą mniej elektronów niż powinny, a jony ujemne przenoszą więcej... Uniwersalny dodatkowy praktyczny słownik objaśniający I. Mostitsky'ego
- (fizyczne) Zgodnie z terminologią wprowadzoną do doktryny elektryczności przez słynnego Faradaya, ciało ulegające rozkładowi pod działaniem prądu galwanicznego nazywa się elektrolitem, rozkład w ten sposób nazywa się elektrolizą, a produkty rozkładu nazywa się jony.... ... Słownik encyklopedyczny F.A. Brockhausa i I.A. Efrona
Książki
- Jony wodoru leczą raka. Promień nadziei, Garbuzow Giennadij Aleksiejewicz. Giennadij Aleksiejewicz Garbuzow to znany naukowiec z Soczi, biolog, wieloletni naśladowca akademika Bołotowa, specjalista w tej dziedzinie leczenie alternatywne choroby onkologiczne. Bylina...
- Jony wodorowe leczą raka Promień nadziei, Garbuzow G.. Giennadij Aleksiejewicz Garbuzow to znany naukowiec z Soczi, biolog, wieloletni naśladowca akademika Bołotowa, specjalista w dziedzinie alternatywnego leczenia chorób onkologicznych. .…
Termin „jon” został po raz pierwszy ukuty w 1834 roku przez Michaela Faradaya. Po zbadaniu wpływu prądu elektrycznego na roztwory soli, zasad i kwasów doszedł do wniosku, że zawierają one cząstki o określonym ładunku. Faradaya nazwał kationy jonami, które w polu elektrycznym przemieszczały się w stronę katody, która ma ładunek ujemny. Aniony to ujemnie naładowane nieelementarne cząstki jonowe, które w polu elektrycznym poruszają się w kierunku plusa – anody.
Terminologia ta jest nadal stosowana, a cząstki są przedmiotem dalszych badań, co pozwala nam rozważyć reakcję chemiczną w wyniku oddziaływania elektrostatycznego. Wiele reakcji przebiega według tej zasady, co pozwoliło zrozumieć ich przebieg i dobrać katalizatory i inhibitory tak, aby przyspieszyć ich przebieg i zahamować syntezę. Dowiedziono również, że wiele substancji, zwłaszcza w roztworach, występuje zawsze w postaci jonów.
Nazewnictwo i klasyfikacja jonów
Jony to naładowane atomy lub grupa atomów, które utraciły lub zyskały elektrony podczas reakcji chemicznej. Tworzą zewnętrzne warstwy atomu i mogą zostać utracone z powodu niskiego przyciągania grawitacyjnego jądra. Wtedy efektem oderwania elektronu jest jon dodatni. Ponadto, jeśli atom ma silny ładunek jądrowy i wąską powłokę elektronową, jądro jest akceptorem dodatkowych elektronów. W rezultacie powstaje cząsteczka jonu ujemnego.
Same jony to nie tylko atomy z nadmiarem lub niedoborem powłoki elektronowej. Może to być również grupa atomów. W przyrodzie najczęściej występują jony grupowe, które są obecne w roztworach, płynach biologicznych organizmów iw woda morska. Istnieje ogromna liczba rodzajów jonów, których nazwy są dość tradycyjne. Kationy to cząstki jonowe, które są naładowane dodatnio, a jony naładowane ujemnie to aniony. Nazywa się je różnie w zależności od ich składu. Na przykład kation sodu, kation cezu i inne. Aniony mają inną nazwę, ponieważ najczęściej składają się z wielu atomów: anion siarczanowy, anion ortofosforanowy i inne.
Mechanizm powstawania jonów
Pierwiastki chemiczne w związkach rzadko są elektrycznie obojętne. Oznacza to, że prawie nigdy nie są w stanie atomów. Podczas tworzenia wiązania kowalencyjnego, które jest uważane za najczęstsze, atomy również mają pewien ładunek, a gęstość elektronów przesuwa się wzdłuż wiązań w cząsteczce. Jednak ładunek jonowy nie powstaje tutaj, ponieważ energia wiązania kowalencyjnego jest mniejsza niż energia jonizacji. Dlatego pomimo różnej elektroujemności niektóre atomy nie mogą całkowicie przyciągać elektronów zewnętrznej warstwy innych.
W reakcjach jonowych, gdzie różnica elektroujemności między atomami jest wystarczająco duża, jeden atom może pobrać elektrony z warstwy zewnętrznej od innego atomu. Powstałe połączenie zostaje wtedy silnie spolaryzowane i pęka. Energia wydatkowana na tę energię, która tworzy ładunek na jonach, nazywana jest energią jonizacji. Jest inny dla każdego atomu i jest wskazany w standardowych tabelach.

Jonizacja jest możliwa tylko wtedy, gdy atom lub grupa atomów jest w stanie albo oddać elektrony, albo je przyjąć. Najczęściej obserwuje się to w roztworach i kryształach soli. Sieć krystaliczna zawiera także prawie nieruchome, naładowane cząstki, pozbawione energii kinetycznej. A ponieważ w krysztale nie ma możliwości ruchu, reakcje jonów najczęściej zachodzą w roztworach.
Jony w fizyce i chemii
Fizycy i chemicy aktywnie badają jony z kilku powodów. Po pierwsze, cząstki te występują we wszystkich znanych stanach skupienia. Po drugie, można zmierzyć energię usuwania elektronów z atomu, aby wykorzystać ją w działaniach praktycznych. Po trzecie, jony zachowują się inaczej w kryształach i roztworach. I po czwarte, jony umożliwiają przewodzenie prądu elektrycznego, a właściwości fizykochemiczne roztworów zmieniają się w zależności od stężenia jonów.

Reakcje jonowe w roztworze
Roztwory i same kryształy należy rozważyć bardziej szczegółowo. W kryształach soli znajdują się oddzielnie jony dodatnie, na przykład kationy sodu i jony ujemne, aniony chloru. Struktura kryształu jest niesamowita: dzięki siłom przyciągania i odpychania elektrostatycznego jony są zorientowane w specjalny sposób. W przypadku chlorku sodu tworzą one tak zwaną sieć krystaliczną diamentu. Tutaj każdy kation sodu jest otoczony przez 6 anionów chlorkowych. Z kolei każdy anion chlorkowy jest otoczony przez 6 anionów chloru. Z tego powodu zwykła sól kuchenna rozpuszcza się zarówno w zimnej, jak i gorącej wodzie z prawie taką samą prędkością.

W roztworze nie ma również pojedynczej cząsteczki chlorku sodu. Każdy z jonów jest tutaj otoczony dipolami wody i porusza się chaotycznie w swojej grubości. Obecność ładunków i oddziaływań elektrostatycznych powoduje, że solankowe roztwory wody zamarzają w temperaturze tuż poniżej zera, a wrzą w temperaturze powyżej 100 stopni. Co więcej, jeśli w roztworze znajdują się inne substancje, które mogą wejść w wiązanie chemiczne, wówczas reakcja zachodzi nie z udziałem cząsteczek, ale jonów. W ten sposób powstała doktryna o etapach reakcji chemicznych.
Produkty otrzymane na końcu nie powstają natychmiast podczas interakcji, ale są stopniowo syntetyzowane z produktów pośrednich. Badanie jonów pozwoliło zrozumieć, że reakcja przebiega dokładnie według zasad oddziaływań elektrostatycznych. Ich efektem jest synteza jonów, które oddziałują elektrostatycznie z innymi jonami, tworząc końcowy produkt reakcji w równowadze.
Wznawiać
Cząstka taka jak jon to naładowany elektrycznie atom lub grupa atomów, która powstaje w wyniku utraty lub wzmocnienia elektronów. Najprostszym jonem jest jon wodorowy: jeśli straci jeden elektron, pozostaje tylko jądrem o ładunku +1. Powoduje powstawanie kwaśnego środowiska w roztworach i środowiskach, co jest istotne dla funkcjonowania układów i organizmów biologicznych.
Jony mogą mieć zarówno ładunki dodatnie, jak i ujemne. Dzięki temu w roztworach każda cząsteczka wchodzi w interakcję elektrostatyczną z dipolami wody, co stwarza także warunki do życia i przekazywania sygnału przez komórki. Ponadto technologia jonowa jest nadal rozwijana. Powstały na przykład silniki jonowe, które wyposażyły już 7 misji kosmicznych NASA.
JONY(z greckiego - chodzenie), cząstki jednoatomowe lub wieloatomowe przenoszące prąd. naładować, np. H + , Li + , Al 3+ , NH 4 + , F- , SO 4 2 - . Jony dodatnie nazywane są kationami (od greckiego kation, dosłownie opadające), jony ujemne nazywane są anionami (od greckiego anion, dosłownie idą w górę). w darmowym stan występuje w fazie gazowej (plazmie). Jony dodatnie w fazie gazowej można otrzymać w wyniku oddzielenia jednego lub większej liczby jonów. elektrony z cząstek obojętnych podczas silnego ogrzewania gazu, działanie prądu elektrycznego. wyładowanie, promieniowanie jonizujące itp. Pochłonięte podczas tworzenia pojedynczego ładunku dodatniego. energia jonów nazywana jest pierwszym potencjałem jonizacji (lub pierwszą energią jonizacji), aby uzyskać podwójnie naładowany jon z pojedynczo naładowanego jonu, zużywana jest druga energia jonizacji itp. Ujemna. Jony powstają w fazie gazowej, gdy przyłączają się do wolnych cząstek. elektrony, a atomy obojętne mogą przyłączyć nie więcej niż jeden elektron; zaprzeczyć. wielokrotnie naładowane jony jednoatomowe nie istnieją w pojedynczym stanie. Nazywa się energię uwalnianą podczas przyłączania się elektronu do cząstki neutralnej. powinowactwo elektronowe. W fazie gazowej jony mogą przyłączać cząsteczki obojętne i tworzyć kompleksy jonowo-cząsteczkowe. Zobacz także Jony w gazach. W skraplaczu fazy, jony znajdują się w kryształach jonowych. sieci i stopy jonowe; w roztworach elektrolitów występuje solwat. jony powstałe w wyniku elektrolitycznego. dysocjacja rozpuszczonej substancji. W skraplaczu w fazie jony intensywnie oddziałują (wiążą się) z otaczającymi je cząsteczkami - jony o przeciwnym znaku w kryształach i w stopach, z cząsteczkami obojętnymi - w roztworach. Wzajemne oddziaływanie zachodzi poprzez mechanizmy kulombowskie, jonowo-dipolowe, donor-akceptor. W roztworach powłoki solwatacyjne tworzą się wokół jonów z cząsteczek rozpuszczalnika związanych z jonami (patrz Hydratacja, Solwatacja). Idea jonów w kryształach jest wygodną idealizacją. modelka, ponieważ Wiązanie czysto jonowe nigdy nie występuje na przykład w kryształach. NaCl, efektywne ładunki atomów Na i Cl są odpowiednio równe. około +0,9 i -0,9. Właściwości jonów w kondensatorze. fazy różnią się znacznie od wartości tych samych jonów w fazie gazowej. W roztworach występują ujemne, podwójnie naładowane jony jednoatomowe. W skraplaczu faza jest wiele różnych. jony wieloatomowe - na przykład aniony zawierające tlen. NIE 3- , SO 4 2 - , jony złożone, np. - 3+, 2 , jony klastrowe 2+ itp. (patrz Klastry), jony polielektrolitów itp. W roztworze jony mogą tworzyć pary jonowe. Termodynamiczny charakterystyka - D H 0 arr., S 0 , D G 0 arr poszczególnych jonów znane są dokładnie tylko dla jonów w fazie gazowej. Dla jonów w roztworach podczas eksperymentów. definicja zawsze uzyskuje sumę wartości termodynamicznych. Charakterystyka kationu i anionu. Teoretycznie możliwe. obliczenia termodynamiczne wartości poszczególnych jonów, ale jego dokładność jest nadal mniejsza niż dokładność eksperymentalna. wyznaczania wartości całkowitych, a więc ze względów praktycznych. celów wykorzystuje się konwencjonalne skale termodynamiczne. zwykle przyjmuje się charakterystykę poszczególnych jonów w roztworze i wartości termodynamiczne. charakterystyka H + równa zeru. Podstawowy charakterystyka strukturalna jonów w skraplaczu. faza - promień i koordynacja. numer. Proponowano wiele różnych rzeczy. skale promieni jonów jednoatomowych. Tzw fizyczny promienie jonów znalezione przez K. Shannona (1969) na podstawie eksperymentów. dane dotyczące minimalnych punktów gęstości elektronowej w kryształach. Koordynat. liczba jonów jednoatomowych w zasadzie. mieszczą się w przedziale 4-8. Biorą udział w wielu różnych dzielnicach. Często są to katalizatory, pośrednie. cząsteczki w chemii p-cje, na przykład podczas reakcji heterolitycznych. Reakcje wymiany jonów w roztworach elektrolitów zwykle zachodzą niemal natychmiast. W elektrycznym jony pola przenoszą elektryczność: kationy - do ujemnego. elektroda (katoda), aniony - do dodatniego (anoda); jednocześnie następuje przeniesienie rzeczy, która gra ważną rolę VJon- jednoatomowa lub wieloatomowa, naładowana elektrycznie cząstka substancji, powstająca w wyniku utraty lub wzmocnienia przez atom w cząsteczce jednego lub większej liczby elektronów.
Ładunek jonu jest wielokrotnością ładunku elektronu. Pojęcie i termin „jon” wprowadził w 1834 roku Michael Faradaya, który badając wpływ prądu elektrycznego na wodne roztwory kwasów, zasad i soli, zasugerował, że przewodnictwo elektryczne takich roztworów wynika z ruchu jonów. Faradaya nazwał dodatnio naładowane jony poruszające się w roztworze w kierunku bieguna ujemnego (katody) kationy i ujemnie naładowane poruszające się w stronę bieguna dodatniego (anoda) - aniony.
Określa się właściwości jonów:
1) znak i wielkość ich ładunku;
2) budowę jonów, czyli rozmieszczenie elektronów i siłę ich wiązań, przy czym szczególnie istotne są elektrony zewnętrzne;
3) ich rozmiary, określone przez promień orbity zewnętrznego elektronu.
4) wytrzymałość powłoki elektronowej (odkształcalność jonów).
W postaci niezależnych cząstek jony występują we wszystkich skupionych stanach materii: w gazach (w szczególności w atmosferze), w cieczach (w stopach i roztworach), w kryształach i plazmie (w szczególności w przestrzeni międzygwiazdowej) .
Jony, będące cząstkami aktywnymi chemicznie, reagują z atomami, cząsteczkami i między sobą. W roztworach jony powstają w wyniku dysocjacji elektrolitycznej i decydują o właściwościach elektrolitów.
Liczba elementarnych ładunki elektryczne dla jonów w roztworach prawie zawsze pokrywa się z wartościowością danego atomu lub grupy; jony gazu mogą mieć różną liczbę ładunków elementarnych. Pod wpływem wystarczająco energetycznych wpływów ( wysoka temperatura, promieniowanie o wysokiej częstotliwości, elektrony o dużej prędkości) mogą powstawać jony dodatnie o różnej liczbie elektronów, aż do gołych jąder. Jony dodatnie są oznaczone znakiem + (plus) lub kropką (na przykład Mg***,Al +++), znak ujemny- (minus) lub znak „(Cl - , Br”). Liczba znaków oznacza liczbę nadmiernych ładunków elementarnych. Najczęściej jony powstają ze stabilnymi zewnętrznymi powłokami elektronowymi odpowiadającymi powłoce gazów szlachetnych. Do tego typu należą przede wszystkim jony, z których zbudowane są kryształy oraz jony występujące w roztworach i rozpuszczalnikach o wysokich stałych dielektrycznych, np. metale alkaliczne i ziem alkalicznych, halogeny itp. Istnieją jednak również tzw. jony przejściowe, w których zewnętrzne powłoki zawierają od 9 do 17 elektronów; jony te mogą stosunkowo łatwo przekształcić się w jony innego rodzaju i znaczenia (na przykład Fe - -, Cu itp.).
Właściwości chemiczne i fizyczne
Chemiczne i właściwości fizyczne jony różnią się znacznie od właściwości atomów obojętnych, pod wieloma względami przypominając właściwości atomów innych pierwiastków, które mają tę samą liczbę elektronów i tę samą zewnętrzną powłokę elektronową (na przykład K” przypomina Ar, F” - Ne). Jony proste, jak pokazuje mechanika falowa, mają kształt kulisty. Wielkości jonów charakteryzują się wielkością ich promieni, które można wyznaczyć empirycznie na podstawie analizy rentgenowskiej kryształów (Goldschmidt) lub obliczyć teoretycznie za pomocą mechaniki falowej (Paulig) lub statystyki (Fermi). Wyniki uzyskane obiema metodami dają w miarę zadowalającą zgodność. Szereg właściwości kryształów i roztworów zależy od promieni jonów, z których się składają; w kryształach tymi właściwościami jest energia sieci krystalicznej i w dużej mierze jej typ; w roztworach jony polaryzują i przyciągają cząsteczki rozpuszczalnika, tworząc powłoki o zmiennym składzie; o tej polaryzacji i sile wiązania między jonami a cząsteczkami rozpuszczalnika decydują prawie wyłącznie promienie i ładunki jonów. Jak silny jest w ogóle wpływ pola jonowego na cząsteczki rozpuszczalnika, pokazują obliczenia Zwicky'ego, który stwierdził, że cząsteczki wody znajdują się w pobliżu jonów pod ciśnieniem około 50 000 atm. Wytrzymałość (odkształcalność) zewnętrznej powłoki elektronowej zależy od stopnia łączności zewnętrznych elektronów i determinuje głównie właściwości optyczne jonów (barwa, załamanie). Jednak kolor jonów jest również związany z tworzeniem się jonów różnych związków z cząsteczkami rozpuszczalnika. Teoretyczne obliczenia efektów związanych z odkształceniem powłoki elektroniczne, są trudniejsze i mniej satysfakcjonujące niż obliczanie sił interakcji między jonami. Przyczyny powstawania jonów w roztworach nie są dokładnie znane; najbardziej prawdopodobna opinia jest taka, że cząsteczki substancji rozpuszczalnych rozkładają się na jony pod wpływem zera cząsteczkowego rozpuszczalnika; heteropolarne, czyli kryształy zbudowane z jonów, najwyraźniej dają jony natychmiast po rozpuszczeniu. Znaczenie pola molekularnego rozpuszczalnika potwierdza równoległość stałej dielektrycznej rozpuszczalnika, będącej przybliżoną miarą napięcia jego pola molekularnego, do stopnia dysocjacji (reguła Nernsta-Thomsona, potwierdzona eksperymentalnie przez Waldena). Jednakże jonizacja zachodzi również w substancjach o niskich stałych dielektrycznych, ale tutaj rozpuszczają się głównie elektrolity, które wytwarzają jony złożone. Czasem z jonów substancji rozpuszczalnej powstają kompleksy, czasem w ich tworzeniu bierze także udział rozpuszczalnik. Substancje o niskich stałych dielektrycznych charakteryzują się również tworzeniem jonów złożonych po dodaniu nieelektrolitów, na przykład (C 2 H 5) 0Br 3 po zmieszaniu z chloroformem daje związek przewodzący
system. Zewnętrzną oznaką powstawania jonów złożonych jest tzw. anomalne przewodnictwo elektryczne, w którym wykres przedstawiający zależność molowego przewodnictwa elektrycznego od rozcieńczenia daje maksimum w obszarze stężonych roztworów i minimum przy dalszym rozcieńczeniu.
Nazewnictwo Zgodnie z nomenklaturą chemiczną nazwa kationu składającego się z jednego atomu pokrywa się z nazwą pierwiastka, np. Na+ nazywa się jonem sodu, czasami w nawiasie dodaje się ładunek, np. nazwę Fe 2 + kation to jon żelaza (II). Nazwa składa się z jednego atomu anionu i jest utworzona z rdzenia łacińskiej nazwy pierwiastka i przyrostka „ -id/-id", na przykład F - nazywany jest jonem fluorkowym.