Hayflickova teorija starenja. Da li je starenje cijena koju treba platiti za suzbijanje tumora raka? Teorija unakrsnog povezivanja
Hayflickova granica ili granica je teorija koja objašnjava prirodu mehanizma iza starenja ćelija. Prema ovoj teoriji, normalna ljudska ćelija je sposobna da se reprodukuje i podeli između četrdeset i šezdeset puta pre nego što izgubi tu sposobnost i propadne kroz programiranu smrt ili apoptozu.
Teorija, nazvana Hayflickova granica, podstakla je naučnike da preispitaju prethodnu teoriju Alexis Carrel, prema kojoj se ćelije mogu beskrajno razmnožavati.
Istorija nastanka Hayflickove teorije
Leonard Hayflick (rođen 20. maja 1928. u Filadelfiji), profesor anatomije na Kalifornijskom univerzitetu u San Francisku, razvio je svoju teoriju dok je radio na Wistar institutu u Filadelfiji, Pensilvanija, 1965. Frank McFarlane Burnet je ovu teoriju nazvao u Hayflicku čast u svojoj knjizi pod naslovom Intrinzična mutageneza, objavljenoj 1974. Koncept Hayflickove granice pomogao je naučnicima da proučavaju efekte starenja ćelije u ljudskom tijelu, razvoj ćelije od embrionalne faze do smrti, uključujući i efekat skraćivanja ćelije. dužina krajeva hromozoma koji se nazivaju telomeri.
Godine 1961. Hayflick je počeo raditi na Wistar institutu, gdje je tokom svojih opservacija vidio da se ljudske ćelije ne dijele beskonačno. Hayflick i Paul Moorhead opisali su ovaj fenomen u monografiji pod naslovom “Serijsko uzgajanje sojeva ljudskih diploidnih ćelija”. Hayflick-ov rad na Wistar institutu imao je za cilj da pruži hranljivo rješenje za naučnike koji sprovode eksperimente na institutu, ali Hayflick je također bio angažiran na vlastitim istraživanjima o efektima virusa u ćelijama. Godine 1965., Hayflick je detaljnije iznio koncept Hayflickove granice u monografiji pod naslovom “Ograničeni životni vijek sojeva ljudskih diploidnih ćelija u vještačkom okruženju”.
Hayflick je došao do zaključka da ćelija može samo dovršiti mitozu, odnosno proces reprodukcije kroz diobu, četrdeset do šezdeset puta, nakon čega dolazi do smrti. Ovaj zaključak se odnosio na sve vrste ćelija, bilo odrasle ili zametne ćelije. Hayflick je iznio hipotezu prema kojoj je minimalni replikativni kapacitet ćelije povezan s njenim starenjem i, shodno tome, s procesom starenja ljudskog tijela.
Godine 1974. Hayflick je suosnivač Nacionalnog instituta za starenje u Bethesdi, Maryland.
Ova institucija je ogranak američkog Nacionalnog instituta za zdravlje. Godine 1982. Hayflick je postao i potpredsjednik Američkog gerontološkog društva, osnovanog 1945. u New Yorku. Nakon toga, Hayflick je radio na popularizaciji svoje teorije i opovrgavanju Carrelove teorije o ćelijskoj besmrtnosti.
Pobijanje Carrelove teorije
Alexis Carrel, francuski hirurg koji je radio sa srčanim tkivom piletine početkom dvadesetog veka, verovao je da su ćelije sposobne da se beskonačno razmnožavaju deobom. Carrel je tvrdio da je uspio postići podjelu ćelija kokošjeg srca u hranljivom mediju - ovaj proces se nastavio više od dvadeset godina. Njegovi eksperimenti s tkivom kokošjeg srca ojačali su teoriju o beskonačnoj diobi ćelija. Naučnici su u više navrata pokušavali da ponove Carrelov rad, ali njihovi eksperimenti nikada nisu potvrdili Carrelovo "otkriće".
Kritika Hayflickove teorije
Devedesetih godina, neki naučnici, kao što je Harry Rubin sa Univerziteta u Kaliforniji, Berkeley, tvrdili su da se Hayflickova granica odnosi isključivo na oštećene ćelije. Rubin je spekulisao da oštećenje ćelija može biti uzrokovano izlaganjem ćelija drugačijem okruženju od njihovog prvobitnog okruženja u telu, ili naučnicima koji izlažu ćelije uslovima u laboratoriji.
Dalja istraživanja fenomena starenja
Uprkos kritikama, drugi naučnici su koristili Hayflickovu teoriju kao osnovu za dalja istraživanja fenomena ćelijskog starenja, posebno telomera, koji su krajevi hromozoma. Telomere štite hromozome i smanjuju mutacije u DNK. Ruski naučnik A. Olovnikov je 1973. godine primenio Hayflickovu teoriju ćelijske smrti u svojim studijama krajeva hromozoma koji se ne reprodukuju tokom mitoze. Prema Olovnikovu, proces ćelijske diobe završava se čim stanica više ne može reproducirati krajeve svojih hromozoma.
Godinu dana kasnije, 1974., Burnet je nazvao Hayflickovu teoriju Hayflickovom granicom, koristeći naziv u svom radu, Intrinzična mutageneza. U središtu Burnetovog rada bila je pretpostavka da je starenje intrinzični faktor u ćelijama različitih oblika života, te da njihova životna aktivnost odgovara teoriji poznatoj kao Hayflickova granica, koja određuje vrijeme smrti organizma.
Elizabeth Blackburn sa Univerziteta u San Francisku i njen kolega Jack Szostak, saradnik na Harvard Medical School u Bostonu, Massachusetts, okrenuli su se Hayflickovoj teoriji granica u svojim studijama strukture telomera 1982. godine, kada su uspjeli klonirati i izolirati telomere.
Godine 1989. Greider i Blackburn poduzeli su sljedeći korak u proučavanju fenomena starenja stanica otkrivši enzim zvan telomeraza (enzim grupe transferaza koji kontrolira veličinu, broj i nukleotidni sastav hromozomskih telomera). Greider i Blackburn su otkrili da prisustvo telomeraze pomaže tjelesnim stanicama da izbjegnu programiranu smrt.
Godine 2009. Blackburn, D. Szostak i K. Greider dobili su Nobelovu nagradu za fiziologiju i medicinu uz tekst “za otkriće mehanizama zaštite hromozoma telomerima i enzimom telomerazom”. Njihovo istraživanje se zasnivalo na Hayflickovom limitu.
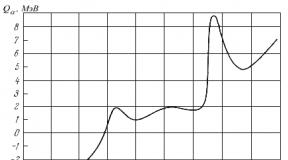
Ideju da se starenje može ustanoviti od trenutka rođenja iznio je njemački darvinistički naučnik August Vajsman (Friedrich Leopold August Weismann, 1834-1914). U svom čuvenom predavanju iz 1891. Weismann je sugerirao da je smrt od starosti nastala u toku evolucije:<Я рассматриваю смерть не как первичную необходимость, а как нечто приобретенное вторично в процессе адаптации:>.
Pristupi klasifikaciji teorija starenja
Teorije koje objašnjavaju starenje organizama mogu se klasificirati na različite načine.
Na primjer, postoji podjela u tri grupe: genetske teorije, u kojima se genetski kontroliše programirano<биологические часы>, kao što su telomeri regulišu rast, zrelost i starenje, neuroendokrine teorije i teorije akumulacije oštećenja. Uopšteno govoreći, ova podjela je prilično proizvoljna, jer su svi ovi mehanizmi važni i međusobno povezani.
Postoje i 2 velike grupe: stohastičke (vjerovatne) teorije i teorije programiranog starenja.
Teorije se mogu klasifikovati prema nivou organizacije žive materije.
Prema V.N. Anisimova, šefa Ruskog gerontološkog društva, najupečatljivije teorije ostaju teorija slobodnih radikala koju je 1956. iznio D. Harman (Harman, 1956, 1998), teorija ćelijskog (replikacijskog) starenja L. Hayflick (Hayflick, Moor , 1961, Hayflick, 1998), telomerna teorija A.M. Olovnikova (Olovnikov, 1971; Olovnikov, 1996); Dilman (Dilman, 1987; Dilman, 1971, 1994) i teorija potrošne some T. Kirkwooda (Kirkwood, 1997, 2002). teoriju slobodnih radikala koju je 1956. iznio D. Harman, teoriju ćelijskog (replikativnog) starenja L. Hayflicka i teoriju telomera A. M. Olovnikova, teoriju elevacije starenja V. M. Dilmana.
Klasifikacija teorija stohastičkog starenja
(Schulz-Aellen, 1997.)
- Teorija somatskih mutacija - Somatske mutacije remete genetske informacije i smanjuju funkciju ćelije
- Katastrofa greške - Greške u procesima transkripcije i/ili translacije smanjuju efikasnost ćelije
- Oštećenje DNK, popravka DNK - oštećenje DNK se stalno popravlja raznim mehanizmima. Efikasnost popravke je u pozitivnoj korelaciji sa očekivanim životnim vekom i opada sa godinama
- Oštećenje proteina - konformacijski poremećaji proteina i enzima (unakrsno povezivanje) oštećuju staničnu funkciju
- Unakrsno povezivanje - Hemijsko umrežavanje važnih makromolekula (kao što je kolagen) dovodi do disfunkcije ćelija i tkiva
- Istrošenost - Akumulacija oštećenja u svakodnevnom životu smanjuje efikasnost organizma
Klasifikacija teorija programiranog starenja
(Schulz-Aellen, 1997.)
- Genetske teorije - Starenje je uzrokovano programiranim promjenama u ekspresiji gena, ili ekspresiji specifičnih proteina
- Geni smrti - Postoje geni za smrt ćelije
- Selektivna smrt – ćelijska smrt je uzrokovana prisustvom specifičnih membranskih receptora
- Skraćivanje telomera - Skraćivanje telomera sa godinama in vitro i in vivo dovodi do nestabilnosti hromozoma i smrti ćelije
- Poremećaji diferencijacije - Greške u mehanizmima aktivacije-represije gena, koje dovode do sinteze suvišnih, neesencijalnih ili nepotrebnih proteina
- Akumulacija<загрязнений>- Akumulacija metaboličkog otpada smanjuje vitalnost ćelija
- Neuroendokrine teorije - Insuficijencija nervnog i endokrinih sistema u održavanju homeostaze. Gubitak homeostaze dovodi do starenja i smrti
- Imunološka teorija – Određeni aleli mogu produžiti ili smanjiti životni vijek.
- Metaboličke teorije - Dugovječnost je obrnuto proporcionalna brzini metabolizma
- Teorija slobodnih radikala - Dugovječnost je obrnuto proporcionalna stepenu oštećenja slobodnih radikala i direktno proporcionalna djelotvornosti antioksidativnih sistema
- Sat starenja - Starenje i smrt su rezultat unaprijed određenog biološkog plana
- Evolucione teorije - Prirodna selekcija eliminira jedinke nakon što proizvedu potomstvo
Klasifikacija najvažnijih teorija starenja prema stepenu integracije
(Jin, Čen, 2005.)
Organski nivo integracije
Teorija trošenja - Sacher, 1966
Teorija katastrofe greške - Orgel, 1963
Teorija oštećenja od stresa - Stlye, 1970
Teorija autointoksikacije - Mečnikov, 1904
Evolucijska teorija(teorija programiranog starenja) - Williams, 1957
Teorija zadržavanja informacija (teorija programiranog starenja)
Nivo organa
Endokrina teorija - Korenčevski, 1961
Imunološka teorija - Walford, 1969
Inhibicija mozga
Ćelijski nivo
Teorija ćelijske membrane - Zg-Nagy, 1978
Teorija somatskih mutacija - Szillard, 1959
Mitohondrijska teorija - Miquel et al., 1980
Mitohondrijsko-lizozomska teorija - Brunk, Terman, 2002
Teorija granice proliferacije ćelije (teorija programiranog starenja) - Hayflick, Moorhead, 1961.
Molekularni nivo
Teorija akumulacije oštećenja DNK - Vilenčik, 1970
Teorija elemenata u tragovima - Eichhorn, 1979
Teorija slobodnih radikala - Harman, 1956
Teorija poprečnih poprečnih veza - Bjorksten, 1968
Teorija oksidativnog stresa - Sohal, Allen, 1990; Yu, Yang, 1996
Teorija neenzimske glikozilacije - Cerami, 1985
Teorija trovanja karbonilom - Yin, Brunk, 1995
Teorija katastrofe zagađenja - Terman, 2001
Teorija genskih mutacija
Teorija skraćivanja telomera (teorija programiranog starenja) - Olovnikov, 1971.
Drugi pristupi
Starenje kao entropija - Sacher, 1967; Bortz, 1986
Matematičke teorije i razne unificirane teorije - Sohal, Alle, 1990;
Zg-Nagy, 1991; Kowald, Kirkwood, 1994
Denham Harmanova teorija slobodnih radikala o starenju

Teorija ćelijskog starenja Leonarda Hayflicka
Teorija elevacije starenja

Predložio i obrazložio početkom 50-ih godina prošlog veka lenjingradski naučnik Vladimir Dilman. Prema ovoj teoriji, mehanizam starenja počinje svoj rad stalnim povećanjem praga osjetljivosti hipotalamusa na nivo hormona u krvi. Kao rezultat, povećava se koncentracija cirkulirajućih hormona. Kao rezultat toga nastaju različiti oblici patoloških stanja, uključujući i one karakteristične za stariju životnu dob: gojaznost, dijabetes, ateroskleroza, kankriofilija, depresija, metabolička imunosupresija, hipertenzija, hiperadaptoza, autoimune bolesti i menopauza. Ove bolesti dovode do starenja i konačno smrti.
Drugim riječima, u tijelu postoji veliki biološki sat koji odbrojava svoj životni vijek od rođenja do smrti. U određenom trenutku ovi satovi pokreću destruktivne procese u tijelu, koji se obično nazivaju starenjem.
Prema Dilmanu, starenje i srodne bolesti su nusproizvod implementacije genetskog programa ontogeneze - razvoja tijela.
Iz ontogenetskog modela proizilazi da ako se stanje homeostaze stabilizira na nivou postignutom do kraja razvoja organizma, onda je moguće usporiti razvoj bolesti i prirodnih senilnih promjena i povećati vrstne granice čovjeka. život.
Preuzmite knjigu "Veliki biološki sat" V. Dilmana
Teorija potrošne (jednokratne) some
Teorija unakrsnog povezivanja

Ovaj mehanizam starenja je nešto poput oštećenja slobodnih radikala. Samo ulogu agresivnih supstanci ovdje imaju šećeri, prvenstveno glukoza koja je uvijek prisutna u organizmu. Šećeri mogu kemijski reagirati s različitim proteinima. U tom slučaju, prirodno, funkcije ovih proteina mogu biti poremećene. Ali ono što je mnogo gore je da molekuli šećera, u kombinaciji sa proteinima, imaju tu sposobnost<сшивать>proteinskih molekula među sobom. Zbog toga ćelije počinju lošije raditi. U njima se nakupljaju ćelijski ostaci.
Jedna od manifestacija takvog umrežavanja proteina je gubitak elastičnosti tkiva. Spolja, najuočljivija stvar je pojava bora na koži. Ali mnogo više štete dolazi od gubitka elastičnosti krvnih sudova i pluća. U principu, ćelije imaju mehanizme za razbijanje takvih unakrsnih veza. Ali ovaj proces zahtijeva puno energije iz tijela.
Danas već postoje lijekovi, koji razgrađuju unutrašnje poprečne veze i pretvaraju ih u hranljive materije za ćeliju.
Teorija greške

Hipoteza<старения по ошибке>iznio je 1954. američki fizičar M. Szilard. Proučavajući djelovanje zračenja na žive organizme, pokazao je da djelovanje jonizujućeg zračenja značajno skraćuje životni vijek ljudi i životinja. Pod uticajem zračenja, u molekuli DNK nastaju brojne mutacije koje pokreću neke simptome starenja, poput sijede kose ili tumora raka. Iz svojih zapažanja, Szilard je zaključio da su mutacije direktni uzrok starenja živih organizama. Međutim, nije objasnio činjenicu starenja ljudi i životinja koje nisu bile izložene zračenju.
Njegov sljedbenik L. Orgel vjerovao je da mutacije u genetskom aparatu ćelije mogu biti ili spontane ili nastati kao odgovor na izlaganje agresivnim faktorima - jonizujuće zračenje, ultraljubičasto zračenje, izlaganje virusima i toksičnim (mutagenim) supstancama itd. Vremenom se sistem za popravku DNK istroši, što uzrokuje starenje tijela.
Teorija apoptoze (ćelijsko samoubistvo)

Akademik V.P. Skulačev svoju teoriju naziva teorijom ćelijske apoptoze. apoptoza (grčki)<листопад>) - proces programirane smrti ćelije. Kao što se drveće oslobađa dijelova da bi očuvalo cjelinu, tako i svaka pojedinačna ćelija, prošavši svoj životni ciklus, mora odumrijeti i na njeno mjesto treba doći nova. Ako se ćelija zarazi virusom, ili u njoj dođe do mutacije koja dovodi do maligniteta, ili joj jednostavno istekne životni vijek, onda ona mora umrijeti da ne bi ugrozila cijeli organizam. Za razliku od nekroze – nasilne ćelijske smrti uslijed ozljeda, opeklina, trovanja, nedostatka kisika kao posljedica začepljenja krvnih žila i sl., apoptozom se stanica pažljivo rastavlja na dijelove, a susjedne stanice koriste njene fragmente kao građevinski materijal.
Mitohondrije takođe prolaze kroz samouništenje - proučavajući ovaj proces, Skulachev ga je nazvao mitoptozom. Mitoptoza nastaje kada se u mitohondrijima proizvodi previše slobodnih radikala. Kada je broj mrtvih mitohondrija previsok, proizvodi njihovog raspada truju ćeliju i dovode do njene apoptoze. Starenje je, sa Skulačeve tačke gledišta, rezultat činjenice da više stanica u tijelu umire nego što se rađa, a umiruće funkcionalne stanice se zamjenjuju. vezivno tkivo. Suština njegovog rada je potraga za metodama za suprotstavljanje uništavanju ćelijskih struktura slobodnim radikalima. Prema naučniku, starost je bolest koja se može i treba lečiti. Program starenja tela može da se onemogući i da se tako isključi mehanizam koji skraćuje naše živote.
Prema Skulačevu, glavni aktivni oblik kisika koji dovodi do smrti mitohondrija i stanica je vodikov peroksid. Trenutno, pod njegovim vodstvom, testira se lijek SKQ, dizajniran da spriječi znakove starenja.
Intervju za Novu gazetu
Adaptaciono-regulatorna teorija

Model starenja koji je razvio istaknuti ukrajinski fiziolog i gerontolog V.V. Frolkisa iz 1960-ih i 70-ih godina, zasniva se na široko rasprostranjenoj ideji da su starost i smrt genetski programirani.<Изюминка>Frolkisova teorija je to razvoj uzrasta i očekivani životni vijek određeni su balansom dva procesa: zajedno s destruktivnim procesom starenja, proces se odvija<антистарения>, za koji je Frolkis predložio termin<витаукт>(latinski vita - život, auctum - povećanje). Ovaj proces je usmjeren na održavanje vitalnosti tijela, njegovu adaptaciju i produženje životnog vijeka. Koncept protiv starenja (vitauct) postao je široko rasprostranjen. Tako je 1995. godine u SAD održan prvi međunarodni kongres o ovom problemu.
Bitna komponenta Frolkisove teorije je hipoteza o regulaciji gena koju je razvio, prema kojoj su primarni mehanizmi starenja poremećaji u funkcionisanju regulatornih gena koji kontrolišu aktivnost strukturnih gena i, kao rezultat toga, intenzitet sinteze gena. proteini koji su kodirani u njima. Poremećaji regulacije gena povezani sa godinama mogu dovesti ne samo do promjena u omjeru sintetiziranih proteina, već i do ekspresije prethodno neaktivnih gena, pojave prethodno nesintetiziranih proteina i, kao rezultat, do starenja i smrti stanica.
V.V. Frolkis je vjerovao da su genski regulatorni mehanizmi starenja osnova za razvoj uobičajenih vrsta patologija povezanih sa starenjem - ateroskleroze, raka, dijabetesa, Parkinsonove i Alchajmerove bolesti. Ovisno o aktivaciji ili supresiji funkcija određenih gena, razvijat će se jedan ili drugi sindrom starenja, jedna ili druga patologija. Na temelju ovih ideja iznesena je ideja o genskoj regulatornoj terapiji, osmišljenoj da spriječi promjene koje su u osnovi razvoja patologije povezane sa starenjem.
Olovnikova reduzomalna teorija

Linearna reduzomalna DNK molekula obložena proteinima je kopija segmenta hromozomske DNK. gnijezdo. Kao i telomerna DNK, linearna reduzomalna DNK se skraćuje tokom vremena. Stoga, sićušni reduzomi progresivno smanjuju veličinu; otuda i njihovo ime. Uz gubitak DNK u reduzomu, smanjuje se i broj različitih gena koji sadrži. Skraćivanje reduzomalnih molekula DNK (i rezultirajuća promjena u setu gena u reduzomima) mijenja nivo ekspresije različitih kromosomskih gena s godinama i zbog toga služi kao ključno sredstvo za mjerenje biološkog vremena u individualnom razvoju.
Ukratko i jednostavno, zvuči ovako: Čak i ako osoba izbjegne bolest i nesreću, njene ćelije će na kraju prestati da se dijele, propadaće i na kraju umrijeti. Ovaj fenomen je poznat kao Hayflickova granica. Istraživanja pokazuju da je trenutni maksimalni životni vijek oko 125 godina.
Evo više o ovoj temi...
Leonard Hayflick otkrio ograničenje broja dioba somatskih stanica, što je približno 50-52 divizije.
“Postoje dvije vrste ljudskih ćelija: reproduktivne ćelije, koje su žensko jaje i sperma muškaraca, i somatske ćelije, koje uključuju oko stotinu triliona drugih ćelija koje čine ostatak tela. Sve stanice se razmnožavaju diobom.
Godine 1961 Leonard Hayflick otkrili da somatske ćelije imaju gornju granicu ukupnog broja dioba, a broj mogućih dioba opada kako stanica stari. Postoji više od jedne teorije koja objašnjava zašto postoji ova takozvana Hayflickova granica.
U osnovi, eksperiment koji je izveo Leonard Hayflick u suradnji s Paulom Moorheadom bio je prilično jednostavan: pomiješani su jednaki dijelovi normalnih muških i ženskih fibroblasta, koji se razlikuju po broju ćelijskih dioba kojima su prošli (muški - 40 podjela, ženski - 10 podjela) kako bi se fibroblasti mogli razlikovati jedni od drugih u budućnosti. Paralelno, stavljena je kontrola sa muškim 40-dnevnim fibroblastima. Kada je kontrolna nepomešana populacija muških ćelija prestala da se deli, mešana eksperimentalna kultura je sadržala samo ženske ćelije, jer su sve muške ćelije već umrle. Na osnovu toga, Hayflick je zaključio da normalne ćelije imaju ograničenu sposobnost dijeljenja, za razliku od stanica raka, koje su besmrtne. Dakle, pretpostavljeno je da se takozvani "mitotički sat" nalazi unutar svake ćelije, na osnovu sledećih zapažanja:
1. Normalni humani fetalni fibroblasti u kulturi su sposobni da udvostruče populaciju samo ograničen broj puta;
2. Ćelije koje su kriogenski tretirane "pamte" koliko su se puta podijelile prije nego što su zamrznute.
Glavni je akumulacija nasumičnih oštećenja gena tokom replikacije ćelije. Svaka ćelijska dioba uključuje okolišne faktore, kao što su dim, zračenje, kemikalije poznate kao hidroksilni slobodni radikali i proizvodi razgradnje stanica, koji ometaju tačnu reprodukciju DNK u sljedećoj generaciji stanica. U tijelu postoji mnogo enzima za popravku DNK koji prate proces kopiranja i ispravljaju probleme s transkripcijom kako se pojave, ali nisu u stanju uhvatiti sve greške. Kako se stanice ponavljaju, oštećenje DNK se nakuplja, što dovodi do nepravilne sinteze proteina i nepravilnog funkcioniranja. Ove funkcionalne greške su pak uzrok bolesti karakterističnih za starenje, kao što su arterioskleroza, bolesti srca i maligni tumori.
Druga teorija kaže da je Hayflickova barijera povezana s telomerima, odnosno nekodirajućim dijelovima DNK koji su pričvršćeni za kraj svakog hromozoma. Telomeri djeluju kao filmski lideri kako bi osigurali tačnu replikaciju DNK. Tokom diobe ćelije, dva lanca DNK se odmotaju i nove potpune kopije ovog molekula se stvaraju u ćelijama kćerima. Ali sa svakom diobom ćelije, telomeri postaju nešto kraći i na kraju više nisu u stanju zaštititi krajeve DNK niti; tada ćelija, pogrešno smatrajući kratke telomere oštećenom DNK, prestaje da raste. Ovca Doli, klonirana iz somatske ćelije odrasle životinje, imala je skraćene telomere odraslih, a ne telomere novorođenog jagnjeta, i možda neće živeti tako dugo kao njena normalno rođena braća i sestre.
Postoje tri glavne vrste ćelija za koje ne postoji Hayflickova granica: zametne ćelije, ćelije raka i neke vrste matičnih ćelija.
Razlog zašto su ove ćelije u stanju da se beskonačno razmnožavaju je prisustvo enzima telomeraze, prvi put izolovanog 1989. godine, koji sprečava skraćivanje telomera. To je ono što omogućava ćelijama zametne linije da se nastavljaju kroz generacije, a to je ono što je u osnovi eksplozivnog rasta tumora raka.”
izvori
Francis Fukuyama, Naša posthumana budućnost: posljedice biotehnološke revolucije, M., “Ast”, 2004, str. 89-90.
Leonard Hayflick otkrio ograničenje broja dioba somatskih stanica, što je približno 50-52 divizije.
“Postoje dvije vrste ljudskih ćelija: reproduktivne ćelije, koje su žensko jaje i sperma muškaraca, i somatske ćelije, koje uključuju oko stotinu triliona drugih ćelija koje čine ostatak tela. Sve stanice se razmnožavaju diobom.
Godine 1961 Leonard Hayflick otkrili da somatske ćelije imaju gornju granicu ukupnog broja dioba, a broj mogućih dioba opada kako stanica stari. Postoji više od jedne teorije koja objašnjava zašto postoji ova takozvana Hayflickova granica.
Glavni je akumulacija nasumičnih oštećenja gena tokom replikacije ćelije. Svaka ćelijska dioba uključuje okolišne faktore, kao što su dim, zračenje, kemikalije poznate kao hidroksilni slobodni radikali i proizvodi razgradnje stanica, koji ometaju tačnu reprodukciju DNK u sljedećoj generaciji stanica. U tijelu postoji mnogo enzima za popravku DNK koji prate proces kopiranja i ispravljaju probleme s transkripcijom kako se pojave, ali nisu u stanju uhvatiti sve greške. Kako se stanice ponavljaju, oštećenje DNK se nakuplja, što dovodi do nepravilne sinteze proteina i nepravilnog funkcioniranja. Ove funkcionalne greške su pak uzrok bolesti karakterističnih za starenje, kao što su arterioskleroza, bolesti srca i maligni tumori.
Druga teorija kaže da je Hayflickova barijera povezana s telomerima, odnosno nekodirajućim dijelovima DNK koji su pričvršćeni za kraj svakog hromozoma. Telomeri djeluju kao filmski lideri kako bi osigurali tačnu replikaciju DNK. Tokom diobe ćelije, dva lanca DNK se odmotaju i nove potpune kopije ovog molekula se stvaraju u ćelijama kćerima. Ali sa svakom diobom ćelije, telomeri postaju nešto kraći i na kraju više nisu u stanju zaštititi krajeve DNK niti; tada ćelija, pogrešno smatrajući kratke telomere oštećenom DNK, prestaje da raste. Ovca Doli, klonirana iz somatske ćelije odrasle životinje, imala je skraćene telomere odraslih, a ne telomere novorođenog jagnjeta, i možda neće živeti tako dugo kao njena normalno rođena braća i sestre.
Postoje tri glavne vrste ćelija za koje ne postoji Hayflickova granica: zametne ćelije, ćelije raka i neke vrste matičnih ćelija.
Razlog zašto su ove ćelije u stanju da se beskonačno razmnožavaju je prisustvo enzima telomeraze, prvi put izolovanog 1989. godine, koji sprečava skraćivanje telomera. To je ono što omogućava ćelijama zametne linije da se nastavljaju kroz generacije, a to je ono što je u osnovi eksplozivnog rasta tumora raka.”
Francis Fukuyama, Naša posthumana budućnost: posljedice biotehnološke revolucije, M., “Ast”, 2004, str. 89-90.
Uvod
Problem starenja organizma i produženja ljudskog života jedna je od najvažnijih tema od interesa za gotovo svaku ljudsku civilizaciju. Proučavanje mehanizama starenja ljudskog tijela ostaje izuzetno stvarni problem i trenutno. Istaknimo samo jedan demografski pokazatelj: do početka 21. vijeka u razvijenim zemljama udio stanovništva koji je navršio 65 ili više godina bio je 10-14%. Prema dostupnim prognozama, ova brojka će se udvostručiti za 20 godina. Starenje stanovništva postavlja mnoge, još uvijek neriješene probleme za modernu medicinu, uključujući i zadatak produljenja života u stanju aktivnog starenja za značajan vremenski period. Nemoguće je riješiti ovaj ogroman zadatak bez predstave o mehanizmima starenja tijela. Mi ćemo se fokusirati samo na raspravu o mehanizmima starenja ćelija, i to onim od njih koji su genetski determinisani, odnosno inherentni ljudskom tijelu od rođenja do smrti.
Hayflick limit
Godine 1961. američki citolog Leonard Hayflick, zajedno sa drugim naučnikom P. Moorheadom, sproveo je eksperimente na uzgoju fibroblasta iz ljudskih embriona. Ovi istraživači su pojedinačne ćelije stavili u hranljivu podlogu (prije inkubacije tkivo je tretirano tripsinom, zbog čega se tkivo disociralo na pojedinačne ćelije). Osim toga, L. Hayflick i P. Moorhead su kao hranljivi medij koristili otopinu aminokiselina, soli i nekih drugih niskomolekularnih komponenti.
U kulturi tkiva fibroblasti su počeli da se dele, a kada je stanični sloj dostigao određenu veličinu, podeljen je na pola, ponovo tretiran tripsinom i prebačen u novu posudu. Takvi prolazi su nastavljeni sve dok se dioba ćelija nije zaustavila. Ovaj fenomen se redovno javljao nakon 50 podjela. Ćelije koje su prestale da se dijele umrle su nakon nekog vremena. Eksperimenti L. Hayflicka i P. Moorheada ponovljeni su mnogo puta u raznim laboratorijama u mnogim zemljama širom svijeta. U svim slučajevima rezultat je bio isti: ćelije koje se dijele (ne samo fibroblasti, već i druge somatske ćelije) prestale su se dijeliti nakon 50-60 subkultura. Kritičan broj dioba somatskih stanica naziva se "Hayflickova granica". Zanimljivo je da se za somatske ćelije različitih vrsta kralježnjaka pokazalo da je Hayflickova granica različita i da je u korelaciji sa životnim vijekom ovih organizama.
Pročitajte i...
- Hoću li se udati? Proricanje sudbine na mreži. Proricanje sudbine za novog poznanika. Proricanje sudbine sa kartama Proricanje sudbine od strane prijatelja
- Morozov Nikolaj Aleksandrovič Nikolaj Morozov Narodnaya Volya
- Možete kuvati pomfrit u mikrotalasnoj. Kako sami napraviti pomfrit u mikrotalasnoj
- Hrskavi kiseli krastavci u teglama