Napišite jednadžbu za reakciju sagorijevanja benzena. Proračun parametara produkata sagorijevanja benzena u zraku. Alkilacija aromatičnih ugljovodonika
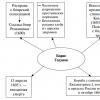
Prva grupa reakcija su supstitucijske reakcije. Rekli smo da areni nemaju višestruke veze u strukturi molekula, već sadrže konjugovani sistem od šest elektrona, koji je veoma stabilan i daje dodatnu snagu benzenskom prstenu. Stoga se u kemijskim reakcijama prvo događa zamjena atoma vodika, a ne uništavanje benzenskog prstena.
Već smo se susreli sa supstitucijskim reakcijama kada smo govorili o alkanima, ali kod njih su te reakcije išle po radikalnom mehanizmu, dok arene karakteriše jonski mehanizam supstitucijskih reakcija.
Prvo hemijska svojstva halogenacije. Zamjena atoma vodika atomom halogena, hlora ili broma.
Reakcija se odvija pri zagrijavanju i uvijek uz učešće katalizatora. U slučaju hlora, to može biti aluminijum hlorid ili željezni hlorid tri. Katalizator polarizira molekul halogena, uzrokujući heterolitičko cijepanje veze i proizvodnju iona.
Klor je pozitivno nabijen ion i reagira s benzenom.
Ako se reakcija odvija s bromom, tada je katalizator željezni bromid ili aluminij bromid.

Važno je napomenuti da se reakcija odvija s molekularnim bromom, a ne s bromnom vodom. Benzen ne reaguje sa bromnom vodom.
Halogenacija homologa benzena ima svoje karakteristike. U molekulu toluena, metil grupa olakšava supstituciju u prstenu, reaktivnost se povećava, a reakcija se odvija u blažim uslovima, odnosno na sobnoj temperaturi.

Važno je napomenuti da se supstitucija uvijek događa u orto i para pozicijama, tako da se dobija mješavina izomera.
Drugo svojstvo nitracije benzena, uvođenje nitro grupe u benzenski prsten.

Teška žućkasta tečnost sa mirisom gorkog badema nastaje nitrobenzen, pa reakcija može biti kvalitativna za benzol. Za nitriranje se koristi nitrirajuća mješavina koncentrirane dušične i sumporne kiseline. Reakcija se izvodi zagrijavanjem.
Da podsjetim da je za nitraciju alkana u Konovalovskoj reakciji korištena razrijeđena dušična kiselina bez dodatka sumporne kiseline.
Prilikom nitriranja toluena, kao i prilikom halogeniranja, nastaje mješavina orto- i para-izomera.

Treće svojstvo alkilacije benzena sa haloalkanima.

Ova reakcija omogućava uvođenje ugljikovodičnih radikala u benzenski prsten i može se smatrati metodom za proizvodnju homologa benzena. Aluminij hlorid se koristi kao katalizator, koji pospješuje razgradnju molekula haloalkana na ione. Grijanje je također neophodno.
Četvrto svojstvo alkilacije benzena sa alkenima.

Na ovaj način možete dobiti, na primjer, kumen ili etilbenzol. Katalizator aluminijum hlorid.
2. Reakcije adicije na benzol
Druga grupa reakcija su reakcije adicije. Rekli smo da ove reakcije nisu tipične, ali su moguće pod prilično strogim uslovima uz uništavanje oblaka pi-elektrona i formiranje šest sigma veza.
Peto svojstvo u općoj listi hidrogenacija, dodavanje vodonika.

Temperatura, pritisak, katalizator nikl ili platina. Toluen može reagovati na isti način.
Šesto hlorisanje imovine. Imajte na umu da govorimo konkretno o interakciji s hlorom, jer brom ne ulazi u ovu reakciju.

Reakcija se javlja pod jakim ultraljubičastim zračenjem. Nastaje heksahlorocikloheksan, drugi naziv za heksahloran, čvrstu supstancu.
Važno je to zapamtiti za benzen nije moguće reakcije adicije halogenovodonika (hidrohalogenacija) i dodavanja vode (hidratacija).
3. Zamjena u bočnom lancu homologa benzena
Treća grupa reakcija odnosi se samo na homologe benzena - ovo je supstitucija u bočnom lancu.
Sedmo svojstvo u općoj listi halogenacije na alfa atomu ugljika u bočnom lancu.

Reakcija se događa kada se zagrije ili ozrači i uvijek samo na alfa ugljiku. Kako se halogenacija nastavlja, drugi atom halogena će se vratiti u alfa položaj.
4. Oksidacija homologa benzena
Četvrta grupa reakcija je oksidacija.
Benzinski prsten je prejak, pa benzen ne oksidira kalijum permanganat ne mijenja boju svoje otopine. Ovo je veoma važno zapamtiti.
Ali homolozi benzena se oksidiraju zakiseljenom otopinom kalijevog permanganata kada se zagrijavaju. A ovo je osmo hemijsko svojstvo.

Time nastaje benzojeva kiselina. Primjećuje se promjena boje otopine. U ovom slučaju, bez obzira koliko je dugačak ugljični lanac supstituenta, on se uvijek prekida nakon prvog atoma ugljika i alfa atom se oksidira u karboksilnu grupu uz stvaranje benzojeve kiseline. Ostatak molekule se oksidira u odgovarajuću kiselinu ili, ako je samo jedan atom ugljika, u ugljični dioksid.
Ako homolog benzena ima više od jednog supstituenta ugljikovodika na aromatičnom prstenu, tada se oksidacija događa prema istim pravilima: ugljik koji se nalazi u alfa položaju se oksidira.

Ovaj primjer proizvodi dvobazičnu aromatičnu kiselinu koja se zove ftalna kiselina.
Posebno bih istakao oksidaciju kumena, izopropilbenzena, atmosferskim kiseonikom u prisustvu sumporne kiseline.

Ovo je takozvana kumenska metoda za proizvodnju fenola. U pravilu se ova reakcija susreće u pitanjima vezanim za proizvodnju fenola. Ovo je industrijska metoda.
Deveto svojstvo sagorijevanja, potpuna oksidacija kisikom. Benzen i njegovi homolozi sagorevaju u ugljen dioksid i vodu.
Napišimo jednačinu sagorevanja benzena u opštem obliku.
Prema zakonu održanja mase, na lijevoj strani treba biti onoliko atoma koliko je atoma na desnoj strani. Jer u kemijskim reakcijama atomi ne nestaju, već se redoslijed veza između njih jednostavno mijenja. Dakle, biće onoliko molekula ugljičnog dioksida koliko ima atoma ugljika u molekuli arena, budući da molekula sadrži jedan atom ugljika. To jest, n CO 2 molekula. Biće dva puta manje molekula vode nego atoma vodonika, odnosno (2n-6)/2, što znači n-3.
Na lijevoj i desnoj strani nalazi se isti broj atoma kisika. Na desnoj strani nalazi se 2n iz ugljičnog dioksida, jer svaka molekula ima dva atoma kisika, plus n-3 iz vode, ukupno 3n-3. Na lijevoj strani nalazi se isti broj atoma kisika 3n-3, što znači da ima dva puta manje molekula, jer molekul sadrži dva atoma. To je (3n-3)/2 molekula kiseonika.
Tako smo sastavili jednačinu za sagorevanje homologa benzena u opštem obliku.
Aromatične HC (arene)– to su ugljovodonici čije molekule sadrže jedan ili više benzenskih prstenova.
Primjeri aromatičnih ugljovodonika:

Arene serije benzena (monociklične arene)
Opća formula:C n H 2n-6 , n≥6
Najjednostavniji predstavnik aromatičnih ugljikovodika je benzen, njegova empirijska formula je C 6 H 6.
Elektronska struktura molekula benzena
Opšta formula monocikličnih arena C n H 2 n -6 pokazuje da su oni nezasićena jedinjenja.
Godine 1856. njemački hemičar A.F. Kekule je predložio cikličku formulu za benzen sa konjugiranim vezama (jednostruke i dvostruke veze naizmenično) - cikloheksatrien-1,3,5: 
Ova struktura molekula benzena nije objasnila mnoga svojstva benzena:
- benzen karakteriziraju reakcije supstitucije, a ne reakcije adicije karakteristične za nezasićene spojeve. Reakcije sabiranja su moguće, ali su teže nego za ;
- benzen ne ulazi u reakcije koje su kvalitativne reakcije na nezasićene ugljovodonike (sa bromnom vodom i otopinom KMnO 4).
Kasnije studije difrakcije elektrona pokazale su da sve veze između atoma ugljika u molekuli benzena imaju istu dužinu od 0,140 nm (srednja vrijednost između dužine jednostavnog S-S konekcije 0,154 nm i dvostruka veza C=C 0,134 nm). Ugao između veza na svakom atomu ugljika je 120°. Molekul je pravilan ravan šestougao.
Moderna teorija za objašnjenje strukture molekule C 6 H 6 koristi ideju hibridizacije atomskih orbitala.
Atomi ugljenika u benzenu su u stanju sp 2 hibridizacije. Svaki "C" atom formira tri σ veze (dvije s atomima ugljika i jednu s atomom vodika). Sve σ veze su u istoj ravni:
Svaki atom ugljika ima jedan p-elektron, koji ne učestvuje u hibridizaciji. Nehibridizirane p-orbitale ugljikovih atoma su u ravni okomitoj na ravan σ veza. Svaki p-oblak se preklapa sa dva susedna p-oblaka, a kao rezultat nastaje jedan konjugovani π-sistem (zapamtite efekat konjugacije p-elektrona u molekuli 1,3-butadiena, o čemu se govori u temi „Dienski ugljovodonici ”):
Kombinacija šest σ-veza sa jednim π-sistemom se naziva aromatična veza.
Prsten od šest ugljikovih atoma povezanih aromatičnom vezom naziva se benzenski prsten ili benzenski prsten.
U skladu sa savremenim idejama o elektronskoj strukturi benzena, molekula C 6 H 6 je prikazana na sledeći način:

Fizička svojstva benzena
Benzen u normalnim uslovima je bezbojna tečnost; t o pl = 5,5 o C; t o kip. = 80 o C; ima karakterističan miris; ne miješa se s vodom, dobar rastvarač, vrlo otrovan.
Hemijska svojstva benzena
Aromatična veza određuje hemijska svojstva benzen i drugi aromatični ugljovodonici.
6π-elektronski sistem je stabilniji od običnih π-veza s dva elektrona. Stoga su reakcije adicije manje tipične za aromatične ugljikovodike nego za nezasićene ugljikovodike. Najkarakterističnije reakcije za arene su supstitucijske reakcije.
I. Reakcije supstitucije
1.Halogenacija

2. Nitracija
Reakcija se izvodi sa mješavinom kiselina (smjesa za nitraciju): 
3.Sulfoniranje

4.Alkilacija (zamjena "H" atoma alkil grupom) - Friedel-Craftsove reakcije, formiraju se homolozi benzena:

Umjesto haloalkana mogu se koristiti alkeni (u prisustvu katalizatora - AlCl 3 ili anorganske kiseline):

II. Reakcije sabiranja
1.Hidrogenacija

2.Dodavanje hlora

III.Reakcije oksidacije
1. Sagorijevanje
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O
2. Nepotpuna oksidacija (KMnO 4 ili K 2 Cr 2 O 7 u kiseloj sredini). Benzinski prsten je otporan na oksidirajuća sredstva. Ne dolazi do reakcije.
Dobijanje benzena
U industriji:
1) prerada nafte i uglja;
2) dehidrogenacija cikloheksana:

3) dehidrociklizacija (aromatizacija) heksana:

U laboratoriji:
Fuzija soli benzojeve kiseline sa:

Izomerizam i nomenklatura homologa benzena
Svaki homolog benzena ima bočni lanac, tj. alkil radikali vezani za benzenski prsten. Prvi homolog benzena je benzenski prsten vezan za metil radikal: 
Toluen nema izomere, jer su sve pozicije u benzenskom prstenu ekvivalentne.
Za naknadne homologe benzena moguća je jedna vrsta izomerizma - izomerija bočnog lanca, koja može biti dva tipa:
1) izomerizam broja i strukture supstituenata;
2) izomerizam položaja supstituenata.



Fizička svojstva toluena
Toluen- bezbojna tečnost sa karakterističnim mirisom, nerastvorljiva u vodi, rastvorljiva u organskim rastvaračima. Toluen je manje toksičan od benzena.
Hemijska svojstva toluena
I. Reakcije supstitucije
1.Reakcije koje uključuju benzenski prsten
Metilbenzen ulazi u sve supstitucijske reakcije u kojima je uključen benzen, a istovremeno pokazuje veću reaktivnost, reakcije se odvijaju brže.
Metilni radikal sadržan u molekuli toluena je supstituent takve vrste, pa se kao rezultat supstitucijskih reakcija u benzenskom prstenu dobijaju orto- i para-derivati toluena ili, u slučaju viška reagensa, triderivati opće formule:

a) halogeniranje


Daljnjom hloracijom mogu se dobiti dihlorometilbenzen i triklorometilbenzen:

II. Reakcije sabiranja
Hidrogenacija

III.Reakcije oksidacije
1.Sagorijevanje
C 6 H 5 CH 3 + 9O 2 → 7CO 2 + 4H 2 O
2. Nepotpuna oksidacija
Za razliku od benzena, njegovi homolozi se oksidiraju određenim oksidacijskim agensima; u ovom slučaju, bočni lanac je podložan oksidaciji, u slučaju toluena, metil grupe. Blagi oksidanti kao što je MnO 2 ga oksidiraju u aldehidnu grupu, jači oksidanti (KMnO 4) uzrokuju dalju oksidaciju u kiselinu: 
Svaki homolog benzena s jednim bočnim lancem oksidira se jakim oksidacijskim sredstvom kao što je KMnO4 u benzojevu kiselinu, tj. bočni lanac puca oksidacijom odcijepljenog dijela do CO 2; na primjer: 
Ako postoji nekoliko bočnih lanaca, svaki od njih se oksidira u karboksilnu grupu i kao rezultat nastaju polibazne kiseline, na primjer:

Dobijanje toluena:
U industriji:
1) prerada nafte i uglja;
2) dehidrogenacija metilcikloheksana:

3) dehidrociklizacija heptana:
U laboratoriji:
1) Friedel-Crafts alkilacija;
2) Wurtz-Fittigova reakcija(reakcija natrijuma sa mješavinom halobenzena i haloalkana).
Arene (aromatični ugljovodonici) – to su nezasićeni (nezasićeni) ciklički ugljovodonici, čiji molekuli sadrže stabilne cikličke grupe atoma (benzenova jezgra) sa zatvorenim sistemom konjugiranih veza.
Opšta formula: C n H 2n–6za n ≥ 6.
Hemijska svojstva arena
Arenas– nezasićeni ugljovodonici, čiji molekuli sadrže tri dvostruke veze i prsten. Ali zbog efekta konjugacije, svojstva arena se razlikuju od svojstava drugih nezasićenih ugljikovodika.
Aromatične ugljikovodike karakteriziraju sljedeće reakcije:
- pristupanja,
- zamjene,
- oksidacija (za homologe benzena).
Aromatični sistem benzena je otporan na oksidaciona sredstva. Međutim, homolozi benzena se oksidiraju kalijevim permanganatom i drugim oksidacijskim agensima.
1. Reakcije sabiranja
Benzen dodaje hlor na svetlost i vodonik kada se zagreva u prisustvu katalizatora.
1.1. Hidrogenacija
Benzen dodaje vodonik kada se zagreva i pod pritiskom u prisustvu metalnih katalizatora (Ni, Pt, itd.).
Kada se benzen hidrogenira, nastaje cikloheksan:
Kada se homolozi hidrogeniraju, nastaju derivati cikloalkana. Kada se toluen zagrije s vodikom pod pritiskom i u prisustvu katalizatora, nastaje metilcikloheksan:
1.2. Kloriranje arena
Dolazi do dodavanja hlora benzenu radikalnim mehanizmom sa visoka temperatura , pod uticajem ultraljubičastog zračenja.
Kada se benzen hloriše na svetlosti, on se formira 1,2,3,4,5,6-heksahlorocikloheksan (heksahloran).
Heksahloran je pesticid koji se koristi za suzbijanje štetnih insekata. Upotreba heksahlorana je trenutno zabranjena.
Homolozi benzena ne dodaju hlor. Ako homolog benzena reaguje sa hlorom ili bromom na svjetlosti ili na visokoj temperaturi (300°C), tada se atomi vodonika zamjenjuju na privjesnom alkil supstituentu, a ne na aromatičnom prstenu.
2. Reakcije supstitucije
2.1. Halogenacija
Benzen i njegovi homolozi ulaze u supstitucijske reakcije sa halogenima (hlor, brom) u prisustvu katalizatora (AlCl 3, FeBr 3) .
Prilikom interakcije s hlorom na AlCl 3 katalizatoru nastaje hlorobenzen:
Aromatični ugljovodonici reaguju sa bromom kada se zagreju i u prisustvu katalizatora - FeBr 3. Metalno gvožđe se takođe može koristiti kao katalizator.
Brom reaguje sa gvožđem i nastaje gvožđe(III) bromid, koji katalizira bromiranje benzena:
Meta-klorotoluen nastaje u malim količinama.
Kada interaguju homolozi benzena sa halogenima na svetlosti ili na visokim temperaturama(300 o C) vodonik se ne zamjenjuje u benzenskom prstenu, već u bočnom ugljovodoničnom radikalu.
Na primjer, kod hloriranja etilbenzena:
2.2. Nitracija
Benzen reaguje sa koncentrovanom azotnom kiselinom u prisustvu koncentrovane sumporne kiseline (smeša za nitraciju).
Ovo proizvodi nitrobenzen:
Toluen reaguje sa koncentrovanom azotnom kiselinom u prisustvu koncentrovane sumporne kiseline.
U produktima reakcije označavamo bilo koje O-nitrotoluen:
ili n-nitrotoluen:
Nitracija toluena također može nastati zamjenom tri atoma vodika. Ovo proizvodi 2,4,6-trinitrotoluen (TNT, tol):
2.3. Alkilacija aromatičnih ugljovodonika
- Areni reaguju sa haloalkanima u prisustvu katalizatora (AlCl 3, FeBr 3, itd.) i formiraju homologe benzena.
- Aromatični ugljovodonici reaguju sa alkenima u prisustvu aluminijum hlorida, gvožđe(III) bromida, fosforne kiseline itd.
- Alkilacija alkoholima se dešava u prisustvu koncentrovane sumporne kiseline.
2.4. Sulfoniranje aromatičnih ugljovodonika
Benzen reagira kada se zagrije s koncentriranom sumpornom kiselinom ili otopinom SO 3 u sumpornoj kiselini (oleumu) da nastane benzensulfonska kiselina:
3. Oksidacija arena
Benzen je otporan čak i na jaka oksidaciona sredstva. Ali homolozi benzena oksidiraju se pod utjecajem jakih oksidacijskih sredstava. Benzen i njegovi homolozi sagorevaju.
3.1. Potpuna oksidacija - sagorijevanje
Kada benzen i njegovi homolozi sagore, nastaju ugljični dioksid i voda. Reakcija sagorijevanja arena praćena je oslobađanjem velike količine topline.
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O + Q
Jednačina sagorevanja arena u opštem obliku:
C n H 2n–6 + (3n – 3)/2 O 2 → nCO 2 + (n – 3)H 2 O + Q
Kada aromatični ugljovodonici sagorevaju u nedostatku kiseonika, može nastati ugljen monoksid CO ili čađa C.
Benzen i njegovi homolozi sagorevaju u vazduhu sa zadimljenim plamenom. Benzen i njegovi homolozi stvaraju eksplozivne smjese sa zrakom i kisikom.
3.2. Ooksidacija homologa benzena
Homolozi benzena lako se oksidiraju kalijevim permanganatom i dikromatom u kiseloj ili neutralnoj sredini kada se zagrijavaju.
Ovo se dešava oksidacija svih veza na atomu ugljika, uz benzenski prsten, osim veze ovog atoma ugljika sa benzenskim prstenom.
Toluen oksidira kalijum permanganat u sumpornoj kiselini sa obrazovanjem benzojeva kiselina:
Ako dođe do oksidacije toluena u neutralnom rastvoru kada se zagreje, tada se formira sol benzojeve kiseline - kalij benzoat:
Dakle, toluen obezbojava zakiseljeni rastvor kalijum permanganata kada se zagreje.
Duži radikali se oksidiraju u benzojevu kiselinu i karboksilnu kiselinu:
Oksidacijom propilbenzena nastaju benzojeva i octena kiselina:
Izopropilbenzen se oksidira kalijevim permanganatom u kiseloj sredini u benzojevu kiselinu i ugljični dioksid:
4. Orijentacijski učinak supstituenata na benzenski prsten
Ako benzenski prsten sadrži supstituente, ne samo alkil, već i druge atome (hidroksil, amino grupu, nitro grupu, itd.), tada se reakcije supstitucije atoma vodonika u aromatičnom sistemu odvijaju na strogo definisan način, u skladu sa priroda uticaj supstituenta na aromatični π-sistem.
Vrste supstituenata na benzenskom prstenu
| Supstituenti prve vrste | Supstituenti druge vrste |
| ortho- I par-pozicija | Dalja zamjena se odvija uglavnom u meta-pozicija |
| Donator elektrona, povećava gustinu elektrona u benzenskom prstenu | Povlačeći elektrone, smanjuju gustinu elektrona u konjugovanom sistemu. |
|
|
Predstavljamo vašoj pažnji video lekciju posvećenu temi "Kemijska svojstva benzena". Koristeći ovaj video, možete steći razumijevanje o hemijskim svojstvima benzena, kao i o teškim uslovima potrebnim da benzen reaguje sa drugim supstancama.
Predmet:Aromatični ugljovodonici
lekcija:Hemijska svojstva benzena
Rice. 1. Molekul benzena
Teško je razbiti oblak p-elektrona u molekulu benzena. Stoga benzen ulazi u kemijske reakcije mnogo manje aktivno u usporedbi s nezasićenim spojevima.


Da bi benzen ušao u hemijske reakcije, potrebni su prilično strogi uslovi: povišena temperatura, au mnogim slučajevima i katalizator. U većini reakcija, stabilni benzenski prsten se zadržava.
1. Bromiranje.

Potreban je katalizator (gvožđe (III) ili aluminijum bromid), a čak i male količine vode nisu dozvoljene. Uloga katalizatora je da molekul broma privlači jedan od atoma broma na atom željeza. Kao rezultat toga, on je polariziran - par veznih elektrona ide do atoma broma povezanog s željezom:
Br +…. Br - FeBr 3 .
Br+ je jak elektrofil. Privlači ga oblak od šest elektrona benzenskog prstena i prekida ga, formirajući kovalentnu vezu sa atomom ugljika:
Anion broma mogao bi se pridružiti rezultirajućem kationu. Ali redukcija aromatičnog sistema benzenskog prstena energetski je povoljnija od dodavanja brom anjona. Stoga molekul prelazi u stabilno stanje, izbacujući vodikov ion:
Sve reakcije elektrofilne supstitucije u benzenskom prstenu odvijaju se sličnim mehanizmom.
2. Nitracija

Benzen i njegovi homolozi reaguju sa mešavinom koncentrisane sumporne i azotne kiseline (smeša za nitraciju). U nitrirajućoj smeši, nitronijum ion NO 2 + postoji u ravnoteži, koji je elektrofil:

3. Sulfoniranje.
Benzen i drugi areni, kada se zagriju, reagiraju s koncentriranom sumpornom kiselinom ili oleumom - otopinom SO 3 u sumpornoj kiselini:

4 . Friedel-Crafts alkilacija
5. Alkilacija sa alkenima

Ove reakcije su energetski nepovoljne i stoga se javljaju samo pri zagrijavanju ili zračenju.
1. Hidrogenacija.
Kada se zagreju, pod povišenim pritiskom i u prisustvu Ni, Pt ili Pd katalizatora, benzen i drugi areni dodaju vodonik da bi se formirao cikloheksan:

2. Kloriranje benzena.
Pod uticajem ultraljubičastog zračenja, benzen dodaje hlor. Ako se tikvica od kvarcnog stakla koja sadrži rastvor hlora u benzenu izloži sunčevoj svetlosti, rastvor će brzo promeniti boju i hlor će se spojiti sa benzenom i formirati 1,2,3,4,5,6-heksahlorcikloheksan, koji je poznat kao heksahloran(ranije korišten kao insekticid):

3. Sagorevanje benzena.
Za razliku od alkana, benzen i drugi aromatični ugljovodonici imaju sjajan, dimljeni plamen.
Sumiranje lekcije
U ovoj lekciji ste proučavali temu “Kemijska svojstva benzena”. Koristeći ovaj materijal, stekli ste razumijevanje o hemijskim svojstvima benzena, kao io teškim uslovima koji su neophodni da benzen reaguje sa drugim supstancama.
Reference
1. Rudžitis G.E. hemija. Osnove opšte hemije. 10. razred: udžbenik za opšteobrazovne ustanove: osnovni nivo/ G. E. Rudzitis, F.G. Feldman. - 14. izdanje. - M.: Obrazovanje, 2012.
2. Hemija. 10. razred. Nivo profila: udžbenik za opšte obrazovanje institucije/ V.V. Eremin, N.E. Kuzmenko, V.V. Lunin i dr. - M.: Drfa, 2008. - 463 str.
3. Hemija. 11. razred. Nivo profila: akademski. za opšte obrazovanje institucije/ V.V. Eremin, N.E. Kuzmenko, V.V. Lunin i dr. - M.: Drfa, 2010. - 462 str.
4. Khomchenko G.P., Khomchenko I.G. Zbirka zadataka iz hemije za one koji upisuju fakultete. - 4. izd. - M.: RIA "Novi talas": Izdavač Umerenkov, 2012. - 278 str.
Domaći
1. br. 13, 14 (str. 62) Rudžitis G.E., Feldman F.G. Hemija: Organska hemija. 10. razred: udžbenik za opšteobrazovne ustanove: osnovni nivo / G. E. Rudzitis, F.G. Feldman. - 14. izdanje. - M.: Obrazovanje, 2012.
2. Zašto se aromatična jedinjenja razlikuju po hemijskim svojstvima i od zasićenih i od nezasićenih ugljovodonika?
3. Napišite jednadžbe reakcije za sagorijevanje etilbenzena i ksilena.