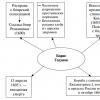
Skriv ekvationen för bensenens förbränningsreaktion. Beräkning av parametrar för bensenförbränningsprodukter i luft. Alkylering av aromatiska kolväten
Den första gruppen av reaktioner är substitutionsreaktioner. Vi sa att arener inte har flera bindningar i molekylens struktur, utan innehåller ett konjugerat system av sex elektroner, vilket är mycket stabilt och ger ytterligare styrka till bensenringen. Därför, i kemiska reaktioner, sker ersättningen av väteatomer först, och inte förstörelsen av bensenringen.
Vi har redan stött på substitutionsreaktioner när vi pratar om alkaner, men för dem följde dessa reaktioner en radikal mekanism, medan arener kännetecknas av en jonisk mekanism av substitutionsreaktioner.
Första halogenering av kemiska egenskaper. Ersättning av en väteatom med en halogenatom, klor eller brom.
Reaktionen sker vid upphettning och alltid med deltagande av en katalysator. När det gäller klor kan det vara aluminiumklorid eller järnklorid tre. Katalysatorn polariserar halogenmolekylen, vilket orsakar heterolytisk bindningsklyvning och producerar joner.
Klor är en positivt laddad jon och reagerar med bensen.
Om reaktionen sker med brom, är katalysatorn järnbromid eller aluminiumbromid.

Det är viktigt att notera att reaktionen sker med molekylärt brom, inte bromvatten. Bensen reagerar inte med bromvatten.
Halogeneringen av bensenhomologer har sina egna egenskaper. I toluenmolekylen underlättar metylgruppen substitution i ringen, reaktiviteten ökar och reaktionen sker under mildare förhållanden, det vill säga vid rumstemperatur.

Det är viktigt att notera att substitution alltid sker i orto- och parapositionerna, så en blandning av isomerer erhålls.
Andra egenskap nitrering av bensen, införande av en nitrogrupp i bensenringen.

En tung gulaktig vätska med doften av bittermandel bildas nitrobensen, så reaktionen kan vara kvalitativ till bensen. För nitrering används en nitreringsblandning av koncentrerad salpetersyra och svavelsyra. Reaktionen utförs genom upphettning.
Låt mig påminna dig om att för nitrering av alkaner i Konovalov-reaktionen användes utspädd salpetersyra utan tillsats av svavelsyra.
Under nitrering av toluen, såväl som under halogenering, bildas en blandning av orto- och para-isomerer.

Tredje egenskapsalkylering av bensen med haloalkaner.

Denna reaktion tillåter införandet av en kolväteradikal i bensenringen och kan betraktas som en metod för framställning av bensenhomologer. Aluminiumklorid används som katalysator, vilket främjar nedbrytningen av haloalkanmolekylen till joner. Uppvärmning är också nödvändig.
Fjärde egenskapsalkylering av bensen med alkener.

På så sätt kan man få till exempel kumen eller etylbensen. Katalysator aluminiumklorid.
2. Additionsreaktioner till bensen
Den andra gruppen av reaktioner är additionsreaktioner. Vi sa att dessa reaktioner inte är typiska, men de är möjliga under ganska stringenta förhållanden med förstörelsen av pi-elektronmolnet och bildandet av sex sigma-bindningar.
Femte egenskap i den allmänna listan hydrering, tillsats av väte.

Temperatur, tryck, katalysator nickel eller platina. Toluen kan reagera på samma sätt.
Sjätte fastighetsklorering. Observera att vi specifikt talar om interaktion med klor, eftersom brom inte går in i denna reaktion.

Reaktionen sker under hård ultraviolett bestrålning. Hexaklorcyklohexan, ett annat namn för hexakloran, ett fast ämne, bildas.
Det är viktigt att komma ihåg det för bensen inte möjligt additionsreaktioner av vätehalogenider (hydrohalogenering) och tillsats av vatten (hydrering).
3. Substitution i sidokedjan av bensenhomologer
Den tredje gruppen av reaktioner gäller endast bensenhomologer - detta är en substitution i sidokedjan.
Sjunde egenskap i den allmänna listan halogenering vid alfa-kolatomen i sidokedjan.

Reaktionen sker vid upphettning eller bestrålning och alltid endast vid alfakolet. När halogeneringen fortsätter kommer den andra halogenatomen att återgå till alfapositionen.
4. Oxidation av bensenhomologer
Den fjärde gruppen av reaktioner är oxidation.
Bensenringen är för stark, så bensen oxiderar inte kaliumpermanganat missfärgar inte lösningen. Detta är mycket viktigt att komma ihåg.
Men bensenhomologer oxideras av en surgjord lösning av kaliumpermanganat när de värms upp. Och detta är den åttonde kemiska egenskapen.

Detta producerar bensoesyra. Missfärgning av lösningen observeras. I det här fallet, oavsett hur lång kolkedjan i substituenten är, bryts den alltid efter den första kolatomen och alfaatomen oxideras till en karboxylgrupp med bildning av bensoesyra. Resten av molekylen oxideras till motsvarande syra eller, om det bara är en kolatom, till koldioxid.
Om en bensenhomolog har mer än en kolvätesubstituent på den aromatiska ringen, sker oxidation enligt samma regler: kolet i alfapositionen oxideras.

Detta exempel producerar en dibasisk aromatisk syra som kallas ftalsyra.
Jag skulle särskilt vilja notera oxidationen av kumen, isopropylbensen, av atmosfäriskt syre i närvaro av svavelsyra.

Detta är den så kallade kumenmetoden för att framställa fenol. Som regel möter man denna reaktion i frågor som rör produktionen av fenol. Detta är en industriell metod.
Nionde egenskapsförbränning, fullständig oxidation med syre. Bensen och dess homologer brinner till koldioxid och vatten.
Låt oss skriva förbränningsekvationen för bensen i allmän form.
Enligt lagen om massans bevarande ska det finnas lika många atomer till vänster som det finns atomer till höger. För i kemiska reaktioner försvinner inte atomer, utan ordningen på bindningarna mellan dem ändras helt enkelt. Så det kommer att finnas lika många koldioxidmolekyler som det finns kolatomer i arenmolekylen, eftersom molekylen innehåller en kolatom. Det vill säga n CO 2 -molekyler. Det kommer att finnas två gånger färre vattenmolekyler än väteatomer, det vill säga (2n-6)/2, vilket betyder n-3.
Det finns samma antal syreatomer till vänster och höger. Till höger finns 2n från koldioxid, eftersom varje molekyl har två syreatomer, plus n-3 från vatten, totalt 3n-3. Till vänster finns det samma antal syreatomer 3n-3, vilket betyder att det finns två gånger färre molekyler, eftersom molekylen innehåller två atomer. Det vill säga (3n-3)/2 syremolekyler.
Sålunda har vi sammanställt en ekvation för förbränning av bensenhomologer i allmän form.
Aromatiska HC:er (arenor)– det är kolväten vars molekyler innehåller en eller flera bensenringar.
Exempel på aromatiska kolväten:

Arenar av bensenserien (monocykliska arener)
Allmän formel:CnH2n-6, n≥6
Den enklaste representanten för aromatiska kolväten är bensen, dess empiriska formel är C 6 H 6.
Elektronisk struktur av bensenmolekylen
Den allmänna formeln för monocykliska arener CnH2n-6 visar att de är omättade föreningar.
1856 gjorde den tyske kemisten A.F. Kekule föreslog en cyklisk formel för bensen med konjugerade bindningar (enkel- och dubbelbindningar alternativa) - cyklohexatrien-1,3,5: 
Denna struktur av bensenmolekylen förklarade inte många av bensens egenskaper:
- bensen kännetecknas av substitutionsreaktioner snarare än additionsreaktioner som är karakteristiska för omättade föreningar. Tilläggsreaktioner är möjliga, men är svårare än för ;
- bensen går inte in i reaktioner som är kvalitativa reaktioner på omättade kolväten (med bromvatten och KMnO 4-lösning).
Senare elektrondiffraktionsstudier visade att alla bindningar mellan kolatomer i en bensenmolekyl har samma längd på 0,140 nm (medelvärdet mellan längden av en enkel S-S-anslutningar 0,154 nm och dubbelbindning C=C 0,134 nm). Vinkeln mellan bindningarna vid varje kolatom är 120°. Molekylen är en vanlig platt hexagon.
Modern teori för att förklara strukturen av C 6 H 6-molekylen använder idén om hybridisering av atomära orbitaler.
Kolatomerna i bensen är i ett tillstånd av sp 2 hybridisering. Varje "C"-atom bildar tre σ-bindningar (två med kolatomer och en med en väteatom). Alla σ-bindningar är i samma plan:
Varje kolatom har en p-elektron, som inte deltar i hybridisering. Kolatomernas ohybridiserade p-orbitaler är i ett plan vinkelrätt mot planet för σ-bindningar. Varje p-moln överlappar med två angränsande p-moln, och som ett resultat bildas ett enda konjugerat π-system (kom ihåg effekten av konjugering av p-elektroner i 1,3-butadienmolekylen, diskuterad i ämnet "Dienkolväten ”):
Kombinationen av sex σ-bindningar med ett enda π-system kallas aromatisk koppling.
En ring med sex kolatomer sammankopplade med en aromatisk bindning kallas bensenring eller bensenring.
I enlighet med moderna idéer om bensens elektroniska struktur avbildas C 6 H 6-molekylen enligt följande:

Bensens fysikaliska egenskaper
Bensen är under normala förhållanden en färglös vätska; topl = 5,5°C; t o kip. = 80°C; har en karakteristisk lukt; blandas inte med vatten, bra lösningsmedel, mycket giftig.
Kemiska egenskaper hos bensen
Den aromatiska kopplingen avgör kemiska egenskaper bensen och andra aromatiska kolväten.
6π-elektronsystemet är mer stabilt än vanliga tvåelektron-π-bindningar. Därför är additionsreaktioner mindre typiska för aromatiska kolväten än för omättade kolväten. De mest karakteristiska reaktionerna för arener är substitutionsreaktioner.
jag. Substitutionsreaktioner
1.Halogenering

2. Nitrering
Reaktionen utförs med en blandning av syror (nitreringsblandning): 
3. Sulfonering

4.Alkylering (ersättning av "H"-atomen med en alkylgrupp) - Friedel-Crafts reaktioner, bensenhomologer bildas:

Istället för haloalkaner kan alkener användas (i närvaro av en katalysator - AlCl 3 eller oorganisk syra):

II. Tilläggsreaktioner
1.Hydrogenering

2. Tillsats av klor

III.Oxidationsreaktioner
1. Förbränning
2C6H6 + 15O2 → 12CO2 + 6H2O
2. Ofullständig oxidation (KMnO 4 eller K 2 Cr 2 O 7 i sur miljö). Bensenringen är resistent mot oxidationsmedel. Ingen reaktion inträffar.
Erhålla bensen
Inom industrin:
1) bearbetning av olja och kol;
2) dehydrering av cyklohexan:

3) dehydrocyklisering (aromatisering) av hexan:

I laboratoriet:
Fusion av bensoesyrasalter med:

Isomerism och nomenklatur för bensenhomologer
Varje homolog av bensen har en sidokedja, dvs. alkylradikaler bundna till en bensenring. Den första bensenhomologen är en bensenring bunden till en metylradikal: 
Toluen har inga isomerer, eftersom alla positioner i bensenringen är ekvivalenta.
För efterföljande homologer av bensen är en typ av isomerism möjlig - sidokedjeisomerism, som kan vara av två typer:
1) isomerism av antalet och strukturen av substituenter;
2) isomerism av substituenternas position.



Fysikaliska egenskaper hos toluen
Toluen- en färglös vätska med en karakteristisk lukt, olöslig i vatten, löslig i organiska lösningsmedel. Toluen är mindre giftigt än bensen.
Kemiska egenskaper hos toluen
jag. Substitutionsreaktioner
1. Reaktioner som involverar bensenringen
Metylbensen går in i alla substitutionsreaktioner där bensen är inblandat, och samtidigt uppvisar högre reaktivitet, reaktioner fortskrider i snabbare takt.
Metylradikalen som ingår i toluenmolekylen är en substituent av detta slag, därför erhålls orto- och para-derivat av toluen som ett resultat av substitutionsreaktioner i bensenringen eller, vid överskott av reagenset, triderivat. av den allmänna formeln:

a) halogenering


Med ytterligare klorering kan diklormetylbensen och triklormetylbensen erhållas:

II. Tilläggsreaktioner
Hydrering

III.Oxidationsreaktioner
1.Förbränning
C6H5CH3 + 9O2 → 7CO2 + 4H2O
2. Ofullständig oxidation
Till skillnad från bensen oxideras dess homologer av vissa oxidationsmedel; i detta fall utsätts sidokedjan för oxidation, i fallet med toluen, metylgruppen. Milda oxidationsmedel som MnO 2 oxiderar det till en aldehydgrupp, starkare oxidationsmedel (KMnO 4) orsakar ytterligare oxidation till en syra: 
Varje homolog av bensen med en sidokedja oxideras av ett starkt oxidationsmedel såsom KMnO4 till bensoesyra, d.v.s. sidokedjan bryter med oxidation av den avspjälkade delen till CO 2; Till exempel: 
Om det finns flera sidokedjor oxideras var och en av dem till en karboxylgrupp och som ett resultat bildas flerbasiska syror, till exempel:

Att få toluen:
Inom industrin:
1) bearbetning av olja och kol;
2) dehydrering av metylcyklohexan:

3) dehydrocyklisering av heptan:
I laboratoriet:
1) Friedel-Crafts-alkylering;
2) Wurtz-Fittig reaktion(reaktion av natrium med en blandning av halobensen och haloalkan).
Arenas (aromatiska kolväten) – dessa är omättade (omättade) cykliska kolväten, vars molekyler innehåller stabila cykliska grupper av atomer (bensenkärnor) med ett slutet system av konjugerade bindningar.
Allmän formel: C n H 2n–6för n ≥ 6.
Kemiska egenskaper hos arenor
Arenas– omättade kolväten, vars molekyler innehåller tre dubbelbindningar och en ring. Men på grund av konjugationseffekten skiljer sig arenes egenskaper från egenskaperna hos andra omättade kolväten.
Aromatiska kolväten kännetecknas av följande reaktioner:
- anslutningar,
- substitutioner,
- oxidation (för bensenhomologer).
Det aromatiska systemet av bensen är resistent mot oxidationsmedel. Emellertid oxideras bensenhomologer av kaliumpermanganat och andra oxidationsmedel.
1. Tilläggsreaktioner
Bensen tillsätter klor i ljuset och väte när det värms upp i närvaro av en katalysator.
1.1. Hydrering
Bensen tillför väte vid upphettning och under tryck i närvaro av metallkatalysatorer (Ni, Pt, etc.).
När bensen hydreras bildas cyklohexan:
När homologer hydreras bildas cykloalkanderivat. När toluen värms upp med väte under tryck och i närvaro av en katalysator, bildas metylcyklohexan:
1.2. Klorering av arenor
Tillsats av klor till bensen sker genom radikal mekanism med hög temperatur , under påverkan av ultraviolett strålning.
När bensen kloreras i ljus bildas det 1,2,3,4,5,6-hexaklorcyklohexan (hexakloran).
Hexakloran är ett bekämpningsmedel som används för att bekämpa skadliga insekter. Det är för närvarande förbjudet att använda hexakloran.
Bensenhomologer tillför inte klor. Om en bensenhomolog reagerar med klor eller brom i ljus eller vid hög temperatur (300°C), då ersätts väteatomer på den vidhängande alkylsubstituenten snarare än på den aromatiska ringen.
2. Substitutionsreaktioner
2.1. Halogenering
Bensen och dess homologer inleder substitutionsreaktioner med halogener (klor, brom) i närvaro av katalysatorer (AlCl 3, FeBr 3) .
Vid interaktion med klor på AlCl 3-katalysatorn bildas klorbensen:
Aromatiska kolväten reagerar med brom vid upphettning och i närvaro av en katalysator - FeBr 3. Metalliskt järn kan också användas som katalysator.
Brom reagerar med järn och bildar järn(III)bromid, som katalyserar bromeringen av bensen:
Meta-klortoluen bildas i små mängder.
När bensenhomologer interagerar med halogener i ljus eller vid höga temperaturer(300 o C) väte ersätts inte i bensenringen, utan i sidokolväteradikalen.
Till exempel, vid klorering av etylbensen:
2.2. Nitrering
Bensen reagerar med koncentrerad salpetersyra i närvaro av koncentrerad svavelsyra (nitreringsblandning).
Detta producerar nitrobensen:
Toluen reagerar med koncentrerad salpetersyra i närvaro av koncentrerad svavelsyra.
I reaktionsprodukterna anger vi antingen O-nitrotoluen:
eller n-nitrotoluen:
Nitrering av toluen kan också ske med ersättning av tre väteatomer. Detta producerar 2,4,6-trinitrotoluen (TNT, tol):
2.3. Alkylering av aromatiska kolväten
- Arener reagerar med haloalkaner i närvaro av katalysatorer (AlCl 3, FeBr 3, etc.) för att bilda bensenhomologer.
- Aromatiska kolväten reagerar med alkener i närvaro av aluminiumklorid, järn(III)bromid, fosforsyra, etc.
- Alkylering med alkoholer sker i närvaro av koncentrerad svavelsyra.
2.4. Sulfonering av aromatiska kolväten
Bensen reagerar vid upphettning med koncentrerad svavelsyra eller en lösning av SO 3 i svavelsyra (oleum) för att bilda bensensulfonsyra:
3. Oxidation av arenor
Bensen är resistent mot även starka oxidationsmedel. Men bensenhomologer oxideras under påverkan av starka oxidationsmedel. Bensen och dess homologer brinner.
3.1. Fullständig oxidation - förbränning
När bensen och dess homologer brinner bildas koldioxid och vatten. Förbränningsreaktionen av arener åtföljs av frigörandet av en stor mängd värme.
2C6H6 + 15O2 → 12CO2 + 6H2O + Q
Förbränningsekvationen för arener i allmän form:
C n H 2n–6 + (3n – 3)/2 O 2 → nCO 2 + (n – 3) H 2 O + F
När aromatiska kolväten brinner i syrebrist kan kolmonoxid CO eller sot C bildas.
Bensen och dess homologer brinner i luften med en rökig låga. Bensen och dess homologer bildar explosiva blandningar med luft och syre.
3.2. OMoxidation av bensenhomologer
Bensenhomologer oxideras lätt av kaliumpermanganat och dikromat i en sur eller neutral miljö när de värms upp.
Detta händer oxidation av alla bindningar vid en kolatom, intill bensenringen, förutom bindningen av denna kolatom med bensenringen.
Toluen oxiderar kaliumpermanganat i svavelsyra med utbildning bensoesyra:
Om toluenoxidation inträffar i en neutral lösning vid upphettning, då bildas den bensoesyrasalt - kaliumbensoat:
Alltså toluen avfärgar en surgjord lösning av kaliumpermanganat när den värms upp.
Längre radikaler oxideras till bensoesyra och karboxylsyra:
Oxidationen av propylbensen producerar bensoe- och ättiksyror:
Isopropylbensen oxideras av kaliumpermanganat i en sur miljö till bensoesyra och koldioxid:
4. Orienterande effekt av substituenter på bensenringen
Om bensenringen innehåller substituenter, inte bara alkyl, utan även innehållande andra atomer (hydroxyl, aminogrupp, nitrogrupp, etc.), så fortskrider substitutionsreaktionerna av väteatomer i det aromatiska systemet på ett strikt definierat sätt, i enlighet med naturen inverkan av substituenten på det aromatiska π-systemet.
Typer av substituenter på bensenringen
| Substituenter av det första slaget | Substituenter av det andra slaget |
| orto- Och par-placera | Ytterligare utbyte sker främst i meta-placera |
| Elektrondonator, ökar elektrondensiteten i bensenringen | Elektronåterdragande reducerar de elektrondensiteten i det konjugerade systemet. |
|
|
Vi presenterar för din uppmärksamhet en videolektion dedikerad till ämnet "Bensens kemiska egenskaper". Med hjälp av den här videon kan du få en förståelse för bensens kemiska egenskaper, samt de svåra förhållanden som krävs för att bensen ska reagera med andra ämnen.
Ämne:Aromatiska kolväten
Lektion:Kemiska egenskaper hos bensen
Ris. 1. Bensenmolekyl
Det är svårt att bryta p-elektronmolnet i en bensenmolekyl. Därför går bensen in i kemiska reaktioner mycket mindre aktivt jämfört med omättade föreningar.


För att bensen ska ingå i kemiska reaktioner krävs ganska stränga villkor: förhöjd temperatur och i många fall en katalysator. I de flesta reaktioner bibehålls den stabila bensenringen.
1. Bromering.

En katalysator (järn (III) eller aluminiumbromid) krävs och även små mängder vatten är inte tillåtna. Katalysatorns roll är att brommolekylen attraheras av en av bromatomerna till järnatomen. Som ett resultat är det polariserat - ett par bindningselektroner går till bromatomen som är associerad med järn:
Br +…. Br - FeBr 3 .
Br+ är en stark elektrofil. Det attraheras av bensenringens sexelektronmoln och bryter det och bildar en kovalent bindning med kolatomen:
En bromanjon kan förena den resulterande katjonen. Men reduktionen av det aromatiska systemet i bensenringen är energetiskt gynnsammare än tillsatsen av bromanjonen. Därför går molekylen in i ett stabilt tillstånd och kastar ut en vätejon:
Alla elektrofila substitutionsreaktioner i bensenringen fortskrider med en liknande mekanism.
2. Nitrering

Bensen och dess homologer reagerar med en blandning av koncentrerad svavelsyra och salpetersyra (nitrerande blandning). I nitreringsblandningen finns nitroniumjonen NO 2 + i jämvikt, vilket är en elektrofil:

3. Sulfonering.
Bensen och andra arener, när de värms upp, reagerar med koncentrerad svavelsyra eller oleum - en lösning av SO 3 i svavelsyra:

4 . Friedel-Crafts alkylering
5. Alkylering med alkener

Dessa reaktioner är energetiskt ogynnsamma och inträffar därför endast när de upphettas eller bestrålas.
1. Hydrering.
Vid upphettning, under förhöjt tryck och i närvaro av en Ni-, Pt- eller Pd-katalysator, tillsätter bensen och andra arener väte för att bilda cyklohexan:

2. Klorering av bensen.
Under påverkan av ultraviolett strålning tillsätter bensen klor. Om en kolv av kvartsglas som innehåller en lösning av klor i bensen utsätts för solljus, kommer lösningen snabbt att missfärgas och klor kommer att kombineras med bensen för att bilda 1,2,3,4,5,6-hexaklorcyklohexan, vilket är känt som hexakloran(tidigare använt som insekticid):

3. Bensenförbränning.
Till skillnad från alkaner har bensen och andra aromatiska kolväten en ljus, rökig låga.
Sammanfattning av lektionen
I den här lektionen studerade du ämnet "Bensens kemiska egenskaper". Med hjälp av detta material kunde du få en förståelse för bensens kemiska egenskaper, samt de svåra förhållanden som är nödvändiga för att bensen ska reagera med andra ämnen.
Referenser
1. Rudzitis G.E. Kemi. Grunderna i allmän kemi. 10:e klass: lärobok för allmänna läroanstalter: grundläggande nivå/G.E. Rudzitis, F.G. Feldman. - 14:e upplagan. - M.: Utbildning, 2012.
2. Kemi. 10:e klass. Profilnivå: lärobok för allmänbildning institutioner/ V.V. Eremin, N.E. Kuzmenko, V.V. Lunin et al. - M.: Bustard, 2008. - 463 sid.
3. Kemi. 11:e klass. Profilnivå: akademisk. för allmänbildning institutioner/ V.V. Eremin, N.E. Kuzmenko, V.V. Lunin et al. - M.: Bustard, 2010. - 462 sid.
4. Khomchenko G.P., Khomchenko I.G. Samling av problem i kemi för dem som går in på universitet. - 4:e uppl. - M.: RIA "New Wave": Förlag Umerenkov, 2012. - 278 sid.
Läxa
1. Nr 13, 14 (s. 62) Rudzitis G.E., Feldman F.G. Kemi: Organisk kemi. 10:e klass: lärobok för allmänna läroanstalter: grundläggande nivå / G. E. Rudzitis, F.G. Feldman. - 14:e upplagan. - M.: Utbildning, 2012.
2. Varför skiljer sig aromatiska föreningar i kemiska egenskaper från både mättade och omättade kolväten?
3. Skriv reaktionsekvationerna för förbränning av etylbensen och xylen.