เขียนสมการปฏิกิริยาการเผาไหม้ของเบนซีน การคำนวณพารามิเตอร์ของผลิตภัณฑ์การเผาไหม้เบนซีนในอากาศ อัลคิเลชันของอะโรมาติกไฮโดรคาร์บอน
ปฏิกิริยากลุ่มแรกคือปฏิกิริยาทดแทน เราบอกว่าเอรีนไม่มีพันธะหลายพันธะในโครงสร้างของโมเลกุล แต่มีระบบคอนจูเกตที่ประกอบด้วยอิเล็กตรอน 6 ตัว ซึ่งมีความเสถียรมากและให้ความแข็งแรงเพิ่มเติมแก่วงแหวนเบนซีน ดังนั้นในปฏิกิริยาเคมี การแทนที่อะตอมไฮโดรเจนจึงเกิดขึ้นก่อน ไม่ใช่การทำลายวงแหวนเบนซีน
เราเคยพบปฏิกิริยาการแทนที่เมื่อพูดถึงอัลเคนแล้ว แต่สำหรับปฏิกิริยาเหล่านี้แล้ว ปฏิกิริยาเหล่านี้เป็นไปตามกลไกที่รุนแรง ในขณะที่เอรีนมีลักษณะเฉพาะด้วยกลไกไอออนิกของปฏิกิริยาการแทนที่
อันดับแรกฮาโลเจนคุณสมบัติทางเคมี การแทนที่อะตอมไฮโดรเจนด้วยอะตอมฮาโลเจน คลอรีน หรือโบรมีน
ปฏิกิริยาเกิดขึ้นเมื่อถูกความร้อนและมีส่วนร่วมของตัวเร่งปฏิกิริยาเสมอ ในกรณีของคลอรีน อาจเป็นอะลูมิเนียมคลอไรด์ หรือเฟอร์ริกคลอไรด์สามก็ได้ ตัวเร่งปฏิกิริยาโพลาไรซ์โมเลกุลฮาโลเจน ทำให้เกิดความแตกแยกของพันธะเฮเทอโรไลติกและผลิตไอออน
คลอรีนเป็นไอออนที่มีประจุบวกและทำปฏิกิริยากับเบนซีน
หากเกิดปฏิกิริยากับโบรมีน ตัวเร่งปฏิกิริยาคือไอรอนโบรไมด์หรืออะลูมิเนียมโบรไมด์

สิ่งสำคัญคือต้องสังเกตว่าปฏิกิริยานี้เกิดขึ้นกับโมเลกุลโบรมีน ไม่ใช่น้ำโบรมีน เบนซินไม่ทำปฏิกิริยากับน้ำโบรมีน
ฮาโลเจนของเบนซีนที่คล้ายคลึงกันมีลักษณะเฉพาะของตัวเอง ในโมเลกุลโทลูอีน หมู่เมทิลเอื้อต่อการแทนที่ในวงแหวน ปฏิกิริยาเพิ่มขึ้น และปฏิกิริยาเกิดขึ้นภายใต้สภาวะที่เบากว่า กล่าวคือ ที่อุณหภูมิห้อง

สิ่งสำคัญคือต้องสังเกตว่าการแทนที่จะเกิดขึ้นในตำแหน่งออร์โธและพาราเสมอ ดังนั้นจึงได้ส่วนผสมของไอโซเมอร์
ที่สองสมบัติไนเตรตของเบนซีน การนำหมู่ไนโตรเข้าไปในวงแหวนเบนซีน

ของเหลวสีเหลืองหนักที่มีกลิ่นอัลมอนด์ขมจะก่อตัวเป็นไนโตรเบนซีน ดังนั้นปฏิกิริยาจึงมีคุณภาพต่อเบนซีน สำหรับไนเตรตจะใช้ส่วนผสมไนเตรตของกรดไนตริกและกรดซัลฟิวริกเข้มข้น ปฏิกิริยาเกิดขึ้นโดยการให้ความร้อน
ฉันขอเตือนคุณว่าสำหรับไนเตรตของอัลเคนในปฏิกิริยา Konovalov นั้นจะใช้กรดไนตริกเจือจางโดยไม่ต้องเติมกรดซัลฟิวริก
ในระหว่างการไนเตรตของโทลูอีนตลอดจนระหว่างฮาโลเจนจะเกิดส่วนผสมของออร์โธ - และพารา - ไอโซเมอร์

ที่สามสมบัติอัลคิเลชันของเบนซีนกับฮาโลอัลเคน

ปฏิกิริยานี้ทำให้เกิดการนำอนุมูลไฮโดรคาร์บอนเข้าไปในวงแหวนเบนซีน และถือได้ว่าเป็นวิธีการผลิตสารคล้ายคลึงกันของเบนซีน อะลูมิเนียมคลอไรด์ใช้เป็นตัวเร่งปฏิกิริยาซึ่งส่งเสริมการสลายตัวของโมเลกุลฮาโลอัลเคนให้เป็นไอออน จำเป็นต้องมีเครื่องทำความร้อนด้วย
ที่สี่สมบัติอัลคิเลชันของเบนซีนกับอัลคีน

ด้วยวิธีนี้ คุณสามารถได้รับ เช่น คิวมีนหรือเอทิลเบนซีน ตัวเร่งปฏิกิริยาอะลูมิเนียมคลอไรด์
2. ปฏิกิริยาเติมเบนซีน
ปฏิกิริยากลุ่มที่สองคือปฏิกิริยาการบวก เราบอกว่าปฏิกิริยาเหล่านี้ไม่ปกติ แต่เกิดขึ้นได้ภายใต้สภาวะที่ค่อนข้างเข้มงวด โดยการทำลายเมฆไพอิเล็กตรอนและการก่อตัวของพันธะซิกมาหกตัว
ประการที่ห้าคุณสมบัติในรายการทั่วไป การเติมไฮโดรเจน การเติมไฮโดรเจน

อุณหภูมิ ความดัน ตัวเร่งปฏิกิริยา นิกเกิล หรือแพลทินัม โทลูอีนสามารถทำปฏิกิริยาในลักษณะเดียวกันได้
ที่หกคุณสมบัติคลอรีน โปรดทราบว่าเรากำลังพูดถึงปฏิกิริยากับคลอรีนโดยเฉพาะ เนื่องจากโบรมีนไม่เข้าสู่ปฏิกิริยานี้

ปฏิกิริยาเกิดขึ้นภายใต้การฉายรังสีอัลตราไวโอเลตที่รุนแรง Hexachlorocyclohexane หรือชื่ออื่นของ hexachlorane ซึ่งเป็นของแข็งได้ถูกสร้างขึ้น
สิ่งสำคัญคือต้องจำไว้ว่าสำหรับน้ำมันเบนซิน เป็นไปไม่ได้ปฏิกิริยาการเติมของไฮโดรเจนเฮไลด์ (ไฮโดรฮาโลเจน) และการเติมน้ำ (ไฮเดรชั่น)
3. การทดแทนในห่วงโซ่ด้านข้างของสารเบนซีนที่คล้ายคลึงกัน
ปฏิกิริยากลุ่มที่สามเกี่ยวข้องกับความคล้ายคลึงกันของเบนซีนเท่านั้น - นี่คือการทดแทนในห่วงโซ่ด้านข้าง
ที่เจ็ดคุณสมบัติในรายการฮาโลเจนทั่วไปที่อะตอมคาร์บอนอัลฟ่าในสายโซ่ด้านข้าง

ปฏิกิริยานี้เกิดขึ้นเมื่อถูกความร้อนหรือฉายรังสี และจะเกิดเฉพาะที่อัลฟ่าคาร์บอนเท่านั้น ในขณะที่ฮาโลเจนยังคงดำเนินต่อไป อะตอมฮาโลเจนที่สองจะกลับสู่ตำแหน่งอัลฟา
4. ออกซิเดชันของสารเบนซีนที่คล้ายคลึงกัน
ปฏิกิริยากลุ่มที่สี่คือปฏิกิริยาออกซิเดชัน
วงแหวนเบนซีนแรงเกินไป เบนซีนก็เลย ไม่ออกซิไดซ์โพแทสเซียมเปอร์แมงกาเนตไม่เปลี่ยนสีสารละลาย นี่เป็นสิ่งสำคัญมากที่ต้องจำ
แต่ความคล้ายคลึงกันของเบนซีนจะถูกออกซิไดซ์โดยสารละลายที่เป็นกรดของโพแทสเซียมเปอร์แมงกาเนตเมื่อถูกความร้อน และนี่คือคุณสมบัติทางเคมีประการที่แปด

สิ่งนี้จะผลิตกรดเบนโซอิก สังเกตการเปลี่ยนสีของสารละลาย ในกรณีนี้ ไม่ว่าสายโซ่คาร์บอนขององค์ประกอบแทนที่จะยาวแค่ไหน มันก็จะแตกหลังจากอะตอมของคาร์บอนตัวแรกเสมอ และอะตอมอัลฟ่าจะถูกออกซิไดซ์เป็นหมู่คาร์บอกซิลที่มีการก่อตัวของกรดเบนโซอิก ส่วนที่เหลือของโมเลกุลจะถูกออกซิไดซ์เป็นกรดที่เกี่ยวข้อง หรือหากเป็นคาร์บอนเพียงอะตอมเดียว ก็จะเป็นคาร์บอนไดออกไซด์
หากความคล้ายคลึงกันของเบนซีนมีองค์ประกอบแทนที่ไฮโดรคาร์บอนมากกว่าหนึ่งตัวบนวงแหวนอะโรมาติก การเกิดออกซิเดชันจะเกิดขึ้นตามกฎเดียวกัน: คาร์บอนที่อยู่ในตำแหน่งอัลฟาจะถูกออกซิไดซ์

ตัวอย่างนี้สร้างกรดอะโรมาติก dibasic ที่เรียกว่ากรดทาทาลิก
ฉันอยากจะสังเกตการเกิดออกซิเดชันของคิวมีน ไอโซโพรพิลเบนซีน โดยออกซิเจนในบรรยากาศโดยมีกรดซัลฟิวริกอยู่เป็นพิเศษ

นี่เป็นวิธีที่เรียกว่าคิวมีนในการผลิตฟีนอล ตามกฎแล้ว เราพบปฏิกิริยานี้ในเรื่องที่เกี่ยวข้องกับการผลิตฟีนอล นี่เป็นวิธีการทางอุตสาหกรรม
เก้าคุณสมบัติการเผาไหม้, ออกซิเดชันโดยสมบูรณ์กับออกซิเจน เบนซีนและความคล้ายคลึงกันของมันจะเผาไหม้เป็นคาร์บอนไดออกไซด์และน้ำ
ให้เราเขียนสมการการเผาไหม้ของเบนซีนในรูปแบบทั่วไป
ตามกฎการอนุรักษ์มวล ควรมีอะตอมทางด้านซ้ายเท่ากับจำนวนอะตอมทางด้านขวา เพราะในปฏิกิริยาเคมี อะตอมจะไม่หายไป แต่ลำดับของพันธะระหว่างอะตอมนั้นเปลี่ยนแปลงไป ดังนั้นจะมีโมเลกุลคาร์บอนไดออกไซด์มากเท่ากับอะตอมของคาร์บอนในโมเลกุลอารีน เนื่องจากโมเลกุลประกอบด้วยอะตอมของคาร์บอนหนึ่งอะตอม นั่นคือ n CO 2 โมเลกุล จะมีโมเลกุลของน้ำน้อยกว่าอะตอมไฮโดรเจนถึงสองเท่า นั่นคือ (2n-6)/2 ซึ่งหมายถึง n-3
มีจำนวนอะตอมออกซิเจนทางซ้ายและขวาเท่ากัน ทางด้านขวามี 2n จากคาร์บอนไดออกไซด์ เนื่องจากแต่ละโมเลกุลมีอะตอมออกซิเจน 2 อะตอม บวก n-3 จากน้ำ รวมเป็น 3n-3 ทางด้านซ้ายมีจำนวนอะตอมออกซิเจน 3n-3 เท่ากัน ซึ่งหมายความว่ามีโมเลกุลน้อยกว่าสองเท่า เนื่องจากโมเลกุลประกอบด้วยอะตอม 2 อะตอม นั่นคือ (3n-3)/2 โมเลกุลออกซิเจน
ดังนั้นเราจึงได้รวบรวมสมการสำหรับการเผาไหม้ของสารเบนซีนที่คล้ายคลึงกันในรูปแบบทั่วไป
Aromatic HCs (สนามกีฬา)– สิ่งเหล่านี้คือไฮโดรคาร์บอนซึ่งมีโมเลกุลประกอบด้วยวงแหวนเบนซีนตั้งแต่หนึ่งวงขึ้นไป
ตัวอย่างของอะโรมาติกไฮโดรคาร์บอน:

สนามประลองของซีรีย์เบนซีน (สนามแบบโมโนไซคลิก)
สูตรทั่วไป:C n H 2n-6 , n≥6
ตัวแทนที่ง่ายที่สุดของอะโรมาติกไฮโดรคาร์บอนคือเบนซีนสูตรเชิงประจักษ์คือ C 6 H 6
โครงสร้างทางอิเล็กทรอนิกส์ของโมเลกุลเบนซีน
สูตรทั่วไปของ monocyclic arenes C n H 2 n -6 แสดงว่าพวกมันเป็นสารประกอบไม่อิ่มตัว
ในปี ค.ศ. 1856 นักเคมีชาวเยอรมัน A.F. Kekule เสนอสูตรไซคลิกสำหรับเบนซีนที่มีพันธะคอนจูเกต (พันธะเดี่ยวและพันธะคู่สลับกัน) - ไซโคลเฮกซาไตรอีน-1,3,5: 
โครงสร้างของโมเลกุลเบนซีนนี้ไม่ได้อธิบายคุณสมบัติของเบนซีนหลายประการ:
- เบนซินมีลักษณะเฉพาะด้วยปฏิกิริยาทดแทนมากกว่าลักษณะปฏิกิริยาการเติมของสารประกอบไม่อิ่มตัว ปฏิกิริยาการเติมเป็นไปได้ แต่ยากกว่าสำหรับ ;
- เบนซินไม่เกิดปฏิกิริยาที่เป็นปฏิกิริยาเชิงคุณภาพต่อไฮโดรคาร์บอนไม่อิ่มตัว (ด้วยน้ำโบรมีนและสารละลาย KMnO 4)
การศึกษาการเลี้ยวเบนของอิเล็กตรอนในเวลาต่อมาพบว่าพันธะทั้งหมดระหว่างอะตอมคาร์บอนในโมเลกุลเบนซีนมีความยาวเท่ากันคือ 0.140 นาโนเมตร (ค่าเฉลี่ยระหว่างความยาวของอะตอมที่เรียบง่าย การเชื่อมต่อ S-S 0.154 นาโนเมตร และพันธะคู่ C=C 0.134 นาโนเมตร) มุมระหว่างพันธะที่อะตอมของคาร์บอนแต่ละอะตอมคือ 120° โมเลกุลเป็นรูปหกเหลี่ยมแบนปกติ
ทฤษฎีสมัยใหม่ในการอธิบายโครงสร้างของโมเลกุล C 6 H 6 ใช้แนวคิดเรื่องการผสมพันธุ์ของออร์บิทัลของอะตอม
อะตอมของคาร์บอนในเบนซีนอยู่ในสถานะการผสมพันธุ์ sp 2 อะตอม "C" แต่ละอะตอมจะสร้างพันธะ σ สามพันธะ (สองพันธะกับอะตอมคาร์บอน และอีกพันธะหนึ่งมีอะตอมไฮโดรเจน) พันธะ σ ทั้งหมดอยู่ในระนาบเดียวกัน:
อะตอมของคาร์บอนแต่ละอะตอมมีพีอิเล็กตรอนหนึ่งตัวซึ่งไม่มีส่วนร่วมในการผสมพันธุ์ p-ออร์บิทัลที่ไม่ถูกไฮบริดของอะตอมคาร์บอนจะอยู่ในระนาบตั้งฉากกับระนาบของพันธะ σ p-cloud แต่ละอันซ้อนทับกับ p-cloud สองอันที่อยู่ติดกัน และผลที่ได้คือระบบ π คอนจูเกตเดี่ยวเกิดขึ้น (จำผลของการผัน p-อิเล็กตรอนในโมเลกุล 1,3-บิวทาไดอีน ที่ได้อภิปรายในหัวข้อ “ไดอีน ไฮโดรคาร์บอน” ”):
การรวมกันของพันธะ σ หกพันธะกับระบบ π เดียวเรียกว่า การเชื่อมต่ออะโรมาติก
วงแหวนของอะตอมคาร์บอนหกอะตอมที่เชื่อมโยงกันด้วยพันธะอะโรมาติกเรียกว่า แหวนเบนซีนหรือ แหวนเบนซีน.
ตามแนวคิดสมัยใหม่เกี่ยวกับโครงสร้างอิเล็กทรอนิกส์ของเบนซีน โมเลกุล C 6 H 6 มีดังต่อไปนี้:

คุณสมบัติทางกายภาพของเบนซีน
เบนซีนภายใต้สภาวะปกติจะเป็นของเหลวไม่มีสี ถึง pl = 5.5 o C; ไม่เป็นไร = 80 องศาเซลเซียส; มีกลิ่นเฉพาะตัว ไม่ผสมน้ำ ตัวทำละลายดี มีพิษสูง
คุณสมบัติทางเคมีของเบนซีน
การเชื่อมต่ออะโรมาติกเป็นตัวกำหนด คุณสมบัติทางเคมีเบนซินและอะโรมาติกไฮโดรคาร์บอนอื่น ๆ
ระบบ 6π อิเล็กตรอนมีความเสถียรมากกว่าพันธะ π 2 อิเล็กตรอนธรรมดา ดังนั้นปฏิกิริยาการเติมจึงเป็นเรื่องปกติสำหรับอะโรมาติกไฮโดรคาร์บอนน้อยกว่าปฏิกิริยาไฮโดรคาร์บอนไม่อิ่มตัว ปฏิกิริยาที่มีลักษณะเฉพาะมากที่สุดสำหรับ arenes คือปฏิกิริยาการทดแทน
ฉัน- ปฏิกิริยาการทดแทน
1.ฮาโลเจน

2. ไนเตรชัน
ปฏิกิริยาเกิดขึ้นกับส่วนผสมของกรด (ส่วนผสมไนเตรต): 
3.ซัลโฟเนชั่น

4.อัลคิเลชั่น (การแทนที่อะตอม “H” ด้วยหมู่อัลคิล) – ปฏิกิริยาของฟรีเดล-คราฟต์, ความคล้ายคลึงกันของเบนซีนเกิดขึ้น:

แทนที่จะใช้ฮาโลอัลเคน สามารถใช้อัลคีนได้ (เมื่อมีตัวเร่งปฏิกิริยา - AlCl 3 หรือกรดอนินทรีย์):

ครั้งที่สอง- ปฏิกิริยาการเติม
1.ไฮโดรเจน

2.การเติมคลอรีน

III.ปฏิกิริยาออกซิเดชัน
1. การเผาไหม้
2C 6H 6 + 15O 2 → 12CO 2 + 6H 2 O
2. ออกซิเดชันที่ไม่สมบูรณ์ (KMnO 4 หรือ K 2 Cr 2 O 7 ในสภาพแวดล้อมที่เป็นกรด) วงแหวนเบนซีนทนทานต่อสารออกซิไดซ์ ไม่มีปฏิกิริยาเกิดขึ้น
การได้รับน้ำมันเบนซิน
ในอุตสาหกรรม:
1) การแปรรูปน้ำมันและถ่านหิน
2) การดีไฮโดรจีเนชันของไซโคลเฮกเซน:

3) ดีไฮโดรไซไลเซชัน (อะโรมาไดซ์) ของเฮกเซน:

ในห้องปฏิบัติการ:
การหลอมรวมเกลือของกรดเบนโซอิกด้วย:

ไอโซเมอริซึมและการตั้งชื่อของสารที่คล้ายคลึงกันของเบนซีน
เบนซินที่คล้ายคลึงกันใดๆ ก็ตามจะมีโซ่ด้านข้าง เช่น อนุมูลอัลคิลจับกับวงแหวนเบนซีน ความคล้ายคลึงกันของเบนซีนประการแรกคือวงแหวนเบนซีนที่จับกับอนุมูลเมทิล: 
โทลูอีนไม่มีไอโซเมอร์ เนื่องจากตำแหน่งทั้งหมดในวงแหวนเบนซีนเท่ากัน
สำหรับความคล้ายคลึงกันของเบนซีนที่ตามมานั้น เป็นไปได้ที่จะเกิดไอโซเมอร์ประเภทหนึ่ง - ไอโซเมอริซึมของสายโซ่ด้านข้างซึ่งสามารถมีได้สองประเภท:
1) ไอโซเมอริซึมของจำนวนและโครงสร้างขององค์ประกอบทดแทน
2) ไอโซเมอริซึมของตำแหน่งขององค์ประกอบทดแทน



คุณสมบัติทางกายภาพของโทลูอีน
โทลูอีน- ของเหลวไม่มีสี มีกลิ่นเฉพาะตัว ไม่ละลายในน้ำ ละลายได้ในตัวทำละลายอินทรีย์ โทลูอีนมีความเป็นพิษน้อยกว่าเบนซีน
คุณสมบัติทางเคมีของโทลูอีน
ฉัน- ปฏิกิริยาการทดแทน
1.ปฏิกิริยาที่เกี่ยวข้องกับวงแหวนเบนซีน
เมธิลเบนซีนจะเข้าสู่ปฏิกิริยาทดแทนทั้งหมดที่มีเบนซีนเกี่ยวข้อง และในขณะเดียวกันก็มีปฏิกิริยาสูงขึ้น ปฏิกิริยาจะเกิดขึ้นที่ความเร็วที่สูงขึ้น
เมทิลเรดิคัลที่มีอยู่ในโมเลกุลโทลูอีนเป็นส่วนประกอบทดแทน ดังนั้น เป็นผลมาจากปฏิกิริยาการแทนที่ในวงแหวนเบนซีน จะได้อนุพันธ์ออร์โธและพาราของโทลูอีน หรือในกรณีที่รีเอเจนต์มากเกินไป จะมีไทรอนุพันธ์ ของสูตรทั่วไป:

ก) ฮาโลเจน


ด้วยคลอรีนเพิ่มเติม สามารถรับไดคลอโรเมทิลเบนซีนและไตรคลอโรเมทิลเบนซีนได้:

ครั้งที่สอง- ปฏิกิริยาการเติม
การเติมไฮโดรเจน

III.ปฏิกิริยาออกซิเดชัน
1.การเผาไหม้
ค 6 ชั่วโมง 5 CH 3 + 9O 2 → 7CO 2 + 4H 2 O
2. ออกซิเดชันที่ไม่สมบูรณ์
ต่างจากเบนซินตรงที่ความคล้ายคลึงกันของมันถูกออกซิไดซ์โดยสารออกซิไดซ์บางชนิด ในกรณีนี้ โซ่ด้านข้างอาจเกิดปฏิกิริยาออกซิเดชัน ในกรณีของโทลูอีน ก็คือกลุ่มเมทิล สารออกซิไดซ์ที่แรงกว่า (KMnO 4) จะทำให้เกิดปฏิกิริยาออกซิเดชันกับกรดเพิ่มเติม: 
ความคล้ายคลึงกันใดๆ ของเบนซีนที่มีโซ่ด้านเดียวจะถูกออกซิไดซ์โดยตัวออกซิไดซ์อย่างแรง เช่น KMnO4 ให้เป็นกรดเบนโซอิก กล่าวคือ โซ่ด้านข้างแตกออกด้วยออกซิเดชั่นของส่วนที่แยกออกเป็น CO 2 ตัวอย่างเช่น: 
หากมีโซ่ด้านข้างหลายเส้น แต่ละโซ่จะถูกออกซิไดซ์เป็นหมู่คาร์บอกซิล และเป็นผลให้กรดโพลีบาซิกเกิดขึ้น เช่น:

การได้รับโทลูอีน:
ในอุตสาหกรรม:
1) การแปรรูปน้ำมันและถ่านหิน
2) การดีไฮโดรจีเนชันของเมทิลไซโคลเฮกเซน:

3) ดีไฮโดรไซไลเซชันของเฮปเทน:
ในห้องปฏิบัติการ:
1) อัลคิเลชันของฟรีเดล-คราฟต์;
2) ปฏิกิริยา Wurtz-Fittig(ปฏิกิริยาของโซเดียมที่มีส่วนผสมของฮาโลเบนซีนและฮาโลอัลเคน)
Arenas (อะโรมาติกไฮโดรคาร์บอน) – สิ่งเหล่านี้คือไฮโดรคาร์บอนไซคลิกไม่อิ่มตัว (ไม่อิ่มตัว) ซึ่งโมเลกุลประกอบด้วยกลุ่มอะตอมไซคลิกที่เสถียร (นิวเคลียสของเบนซีน) พร้อมระบบปิดของพันธะคอนจูเกต
สูตรทั่วไป: C n H 2n–6สำหรับ n ≥ 6
คุณสมบัติทางเคมีของอารีเนส
อารีน่า- ไฮโดรคาร์บอนไม่อิ่มตัว โมเลกุลประกอบด้วยพันธะคู่ 3 พันธะและวงแหวน 1 วง แต่เนื่องจากผลของการผันคำกริยา คุณสมบัติของเอรีนจึงแตกต่างจากคุณสมบัติของไฮโดรคาร์บอนไม่อิ่มตัวชนิดอื่น
อะโรมาติกไฮโดรคาร์บอนมีลักษณะเฉพาะโดยปฏิกิริยาต่อไปนี้:
- ภาคยานุวัติ,
- การทดแทน
- ออกซิเดชัน (สำหรับความคล้ายคลึงกันของเบนซีน)
ระบบอะโรมาติกของเบนซีนสามารถทนต่อสารออกซิไดซ์ได้ อย่างไรก็ตาม สารที่คล้ายคลึงกันของเบนซีนจะถูกออกซิไดซ์โดยโพแทสเซียมเปอร์แมงกาเนตและสารออกซิไดซ์อื่น ๆ
1. ปฏิกิริยาการเติม
เบนซีนจะเติมคลอรีนในแสงและไฮโดรเจนเมื่อถูกความร้อนโดยมีตัวเร่งปฏิกิริยา
1.1. การเติมไฮโดรเจน
เบนซินจะเติมไฮโดรเจนเมื่อถูกความร้อนและภายใต้ความกดดันโดยมีตัวเร่งปฏิกิริยาที่เป็นโลหะ (Ni, Pt ฯลฯ)
เมื่อเบนซีนถูกเติมไฮโดรเจน จะเกิดไซโคลเฮกเซน:
เมื่อโฮโมล็อกถูกเติมไฮโดรเจน จะเกิดอนุพันธ์ของไซโคลอัลเคน เมื่อโทลูอีนถูกให้ความร้อนด้วยไฮโดรเจนภายใต้ความกดดันและมีตัวเร่งปฏิกิริยา จะเกิดเมทิลไซโคลเฮกเซน:
1.2. การคลอรีนในสนามกีฬา
เกิดการเติมคลอรีนลงในเบนซีน ด้วยกลไกที่รุนแรงด้วย อุณหภูมิสูง ภายใต้อิทธิพลของรังสีอัลตราไวโอเลต
เมื่อเบนซีนถูกคลอรีนในแสงจะก่อตัวขึ้น 1,2,3,4,5,6-เฮกซาคลอโรไซโคลเฮกเซน (เฮกซะคลอเรน).
เฮกซะคลอเรนเป็นยาฆ่าแมลงที่ใช้ในการควบคุมแมลงที่เป็นอันตราย ปัจจุบันห้ามใช้เฮกซาคลอเรน
ความคล้ายคลึงกันของเบนซีนไม่เติมคลอรีน หากสารโฮโมลอกของเบนซีนทำปฏิกิริยากับคลอรีนหรือโบรมีน ในที่มีแสงหรือที่อุณหภูมิสูง (300°C)จากนั้นอะตอมของไฮโดรเจนก็จะถูกแทนที่ บนจี้แทนอัลคิลแทนที่จะอยู่บนวงแหวนอะโรมาติก
2. ปฏิกิริยาการทดแทน
2.1. ฮาโลเจน
เบนซีนและความคล้ายคลึงกันของมันจะเข้าสู่ปฏิกิริยาทดแทนกับฮาโลเจน (คลอรีน, โบรมีน) เมื่อมีตัวเร่งปฏิกิริยา (AlCl 3, FeBr 3) .
เมื่อทำปฏิกิริยากับคลอรีนบนตัวเร่งปฏิกิริยา AlCl 3 จะเกิดคลอโรเบนซีน:
อะโรเมติกไฮโดรคาร์บอนทำปฏิกิริยากับโบรมีนเมื่อถูกความร้อนและมีตัวเร่งปฏิกิริยา - กุมภาพันธ์ 3 เหล็กโลหะยังสามารถใช้เป็นตัวเร่งปฏิกิริยาได้
โบรมีนทำปฏิกิริยากับเหล็กจนเกิดเป็นเหล็ก (III) โบรไมด์ ซึ่งไปกระตุ้นโบรมีนของเบนซีน:
เมตา-คลอโรโทลูอีนเกิดขึ้นในปริมาณน้อย
เมื่อความคล้ายคลึงกันของเบนซีนมีปฏิสัมพันธ์กัน กับฮาโลเจนในที่มีแสงหรือที่อุณหภูมิสูงไฮโดรเจน (300 o C) ไม่ได้ถูกแทนที่ในวงแหวนเบนซีน แต่แทนที่ในอนุมูลไฮโดรคาร์บอนด้านข้าง
ตัวอย่างเช่น เมื่อเติมคลอรีนเอทิลเบนซีน:
2.2. ไนเตรชัน
เบนซีนทำปฏิกิริยากับกรดไนตริกเข้มข้นเมื่อมีกรดซัลฟิวริกเข้มข้น (ส่วนผสมไนเตรต)
สิ่งนี้จะผลิตไนโตรเบนซีน:
โทลูอีนทำปฏิกิริยากับกรดไนตริกเข้มข้นเมื่อมีกรดซัลฟิวริกเข้มข้น
ในผลิตภัณฑ์ที่ทำปฏิกิริยาเราระบุอย่างใดอย่างหนึ่ง โอ-ไนโตรโทลูอีน:
หรือ n-ไนโตรโทลูอีน:
ไนเตรชันของโทลูอีนสามารถเกิดขึ้นได้ด้วยการแทนที่อะตอมไฮโดรเจนสามอะตอม สิ่งนี้ทำให้เกิด 2,4,6-trinitrotoluene (TNT, tol):
2.3. อัลคิเลชันของอะโรมาติกไฮโดรคาร์บอน
- Arenes ทำปฏิกิริยากับฮาโลอัลเคนต่อหน้าตัวเร่งปฏิกิริยา (AlCl 3, FeBr 3 ฯลฯ) เพื่อสร้างความคล้ายคลึงกันของเบนซีน
- อะโรเมติกไฮโดรคาร์บอนทำปฏิกิริยากับอัลคีนเมื่อมีอะลูมิเนียมคลอไรด์, เหล็ก (III) โบรไมด์, กรดฟอสฟอริก ฯลฯ
- อัลคิเลชั่นกับแอลกอฮอล์เกิดขึ้นเมื่อมีกรดซัลฟิวริกเข้มข้น
2.4. ซัลโฟเนชันของอะโรมาติกไฮโดรคาร์บอน
เบนซีนทำปฏิกิริยาเมื่อถูกความร้อนด้วยกรดซัลฟิวริกเข้มข้นหรือสารละลาย SO 3 ในกรดซัลฟิวริก (โอเลี่ยม) เพื่อสร้างกรดเบนซีนซัลโฟนิก:
3. การเกิดออกซิเดชันของ arenes
เบนซินสามารถทนต่อสารออกซิไดซ์ที่แรงได้ แต่ความคล้ายคลึงกันของเบนซีนจะถูกออกซิไดซ์ภายใต้อิทธิพลของสารออกซิไดซ์ที่แรง น้ำมันเบนซินและความคล้ายคลึงกันของมันถูกเผาไหม้
3.1. ออกซิเดชันโดยสมบูรณ์ - การเผาไหม้
เมื่อเบนซีนและสารที่คล้ายคลึงกันเผาไหม้ จะเกิดก๊าซคาร์บอนไดออกไซด์และน้ำ ปฏิกิริยาการเผาไหม้ของอารีนจะมาพร้อมกับการปล่อยความร้อนจำนวนมาก
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O + Q
สมการการเผาไหม้ของ arenes ในรูปแบบทั่วไป:
C n H 2n–6 + (3n – 3)/2 O 2 → nCO 2 + (n – 3)H 2 O + ถาม
เมื่ออะโรมาติกไฮโดรคาร์บอนเผาไหม้โดยขาดออกซิเจน จะเกิดก๊าซคาร์บอนมอนอกไซด์ CO หรือเขม่า C ได้
เบนซินและสารที่คล้ายคลึงกันของมันถูกเผาไหม้ในอากาศพร้อมกับเปลวไฟที่เป็นควัน เบนซีนและความคล้ายคลึงกันของมันคือสารผสมที่ระเบิดได้กับอากาศและออกซิเจน
3.2. เกี่ยวกับออกซิเดชันของสารเบนซีนที่คล้ายคลึงกัน
สารที่คล้ายคลึงกันของเบนซีนจะถูกออกซิไดซ์ได้ง่ายโดยโพแทสเซียมเปอร์แมงกาเนตและไดโครเมตในสภาพแวดล้อมที่เป็นกรดหรือเป็นกลางเมื่อถูกความร้อน
สิ่งนี้เกิดขึ้น ออกซิเดชันของพันธะทั้งหมดที่อะตอมคาร์บอนติดกับวงแหวนเบนซีน ยกเว้นพันธะของอะตอมคาร์บอนนี้กับวงแหวนเบนซีน
โทลูอีนออกซิไดซ์ โพแทสเซียมเปอร์แมงกาเนตในกรดซัลฟิวริกด้วยการศึกษา กรดเบนโซอิก:
หากโทลูอีนออกซิเดชั่นเกิดขึ้น ในสารละลายที่เป็นกลางเมื่อถูกความร้อนแล้วมันก็ก่อตัวขึ้นมา เกลือของกรดเบนโซอิก - โพแทสเซียมเบนโซเอต:
ดังนั้นโทลูอีน ลดสีของสารละลายที่เป็นกรดของโพแทสเซียมเปอร์แมงกาเนตเมื่อถูกความร้อน
อนุมูลที่ยาวกว่าจะถูกออกซิไดซ์เป็นกรดเบนโซอิกและกรดคาร์บอกซิลิก:
ออกซิเดชันของโพรพิลเบนซีนทำให้เกิดกรดเบนโซอิกและอะซิติก:
ไอโซโพรพิลเบนซีนถูกออกซิไดซ์โดยโพแทสเซียมเปอร์แมงกาเนตในสภาพแวดล้อมที่เป็นกรดไปจนถึงกรดเบนโซอิกและคาร์บอนไดออกไซด์:
4. ผลกระทบของสารทดแทนบนวงแหวนเบนซีน
หากวงแหวนเบนซีนมีองค์ประกอบทดแทน ไม่เพียงแต่อัลคิลเท่านั้น แต่ยังมีอะตอมอื่น ๆ ด้วย (ไฮดรอกซิล, หมู่อะมิโน, หมู่ไนโตร ฯลฯ ) ปฏิกิริยาการแทนที่อะตอมไฮโดรเจนในระบบอะโรมาติกจะดำเนินการในลักษณะที่กำหนดไว้อย่างเคร่งครัดตาม ธรรมชาติ อิทธิพลขององค์ประกอบแทนที่ต่อระบบอะโรมาติก π
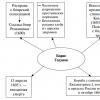
ประเภทของสารทดแทนบนวงแหวนเบนซีน
| สารทดแทนประเภทที่หนึ่ง | สารทดแทนประเภทที่สอง |
| ออร์โธ- และ คู่-ตำแหน่ง | การทดแทนเพิ่มเติมเกิดขึ้นส่วนใหญ่ใน เมตาดาต้า-ตำแหน่ง |
| ผู้บริจาคอิเล็กตรอน ช่วยเพิ่มความหนาแน่นของอิเล็กตรอนในวงแหวนเบนซีน | การถอนอิเล็กตรอนจะช่วยลดความหนาแน่นของอิเล็กตรอนในระบบคอนจูเกต |
|
|
เรานำเสนอบทเรียนวิดีโอเกี่ยวกับหัวข้อ "คุณสมบัติทางเคมีของเบนซีน" ให้กับคุณโดยเฉพาะ เมื่อใช้วิดีโอนี้ คุณจะเข้าใจคุณสมบัติทางเคมีของเบนซีน รวมถึงสภาวะที่ไม่เอื้ออำนวยที่จำเป็นสำหรับเบนซีนในการทำปฏิกิริยากับสารอื่นๆ
เรื่อง:อะโรมาติกไฮโดรคาร์บอน
บทเรียน:คุณสมบัติทางเคมีของเบนซีน
ข้าว. 1. โมเลกุลของเบนซีน
เป็นการยากที่จะทำลายเมฆพีอิเล็กตรอนในโมเลกุลเบนซีน ดังนั้นเบนซินจึงเข้าสู่ปฏิกิริยาเคมีน้อยกว่ามากเมื่อเปรียบเทียบกับสารประกอบไม่อิ่มตัว


เพื่อให้เบนซีนเกิดปฏิกิริยาเคมีได้ จำเป็นต้องมีสภาวะที่ค่อนข้างเข้มงวด เช่น อุณหภูมิที่สูงขึ้น และในหลายกรณี ต้องใช้ตัวเร่งปฏิกิริยา ในปฏิกิริยาส่วนใหญ่ วงแหวนเบนซีนที่เสถียรจะยังคงอยู่
1- โบรมีน.

ต้องใช้ตัวเร่งปฏิกิริยา (เหล็ก (III) หรืออะลูมิเนียมโบรไมด์) และไม่อนุญาตให้ใช้น้ำแม้แต่ปริมาณเล็กน้อย บทบาทของตัวเร่งปฏิกิริยาคือโมเลกุลโบรมีนถูกดึงดูดโดยอะตอมโบรมีนตัวใดตัวหนึ่งไปยังอะตอมของเหล็ก เป็นผลให้เกิดขั้ว - อิเล็กตรอนคู่พันธะจะไปที่อะตอมโบรมีนที่เกี่ยวข้องกับเหล็ก:
บ +…. Br - กุมภาพันธ์ 3 .
Br+ เป็นอิเล็กโทรไลต์ชนิดรุนแรง มันถูกดึงดูดไปยังเมฆหกอิเล็กตรอนของวงแหวนเบนซีน และทำให้มันแตกออก ก่อให้เกิดพันธะโควาเลนต์กับอะตอมของคาร์บอน:
ไอออนโบรมีนสามารถเข้าร่วมกับไอออนบวกที่เกิดขึ้นได้ แต่การลดลงของระบบอะโรมาติกของวงแหวนเบนซีนนั้นมีประโยชน์มากกว่าการเติมโบรมีนไอออน ดังนั้นโมเลกุลจึงเข้าสู่สถานะเสถียรโดยปล่อยไฮโดรเจนไอออนออกมา:
ปฏิกิริยาการแทนที่อิเล็กโทรฟิลิกทั้งหมดในวงแหวนเบนซีนดำเนินไปโดยกลไกที่คล้ายกัน
2- ไนเตรชัน

เบนซีนและความคล้ายคลึงกันของมันทำปฏิกิริยากับส่วนผสมของกรดซัลฟิวริกเข้มข้นและกรดไนตริก (ส่วนผสมไนเตรต) ในส่วนผสมของไนเตรต ไนตรอนไอออน NO 2 + มีอยู่ในสภาวะสมดุล ซึ่งเป็นอิเล็กโทรฟิล:

3. ซัลโฟเนชั่น
เบนซีนและอารีนอื่น ๆ เมื่อถูกความร้อนจะทำปฏิกิริยากับกรดซัลฟิวริกเข้มข้นหรือโอเลี่ยม - สารละลาย SO 3 ในกรดซัลฟิวริก:

4 - อัลคิเลชันของฟรีเดล-คราฟต์
5. อัลคิเลชันกับอัลคีน

ปฏิกิริยาเหล่านี้ไม่เป็นผลดีอย่างมาก ดังนั้นจะเกิดขึ้นเมื่อได้รับความร้อนหรือถูกฉายรังสีเท่านั้น
1. การเติมไฮโดรเจน
เมื่อถูกความร้อนภายใต้ความดันสูง และเมื่อมีตัวเร่งปฏิกิริยา Ni, Pt หรือ Pd เบนซินและเอรีนอื่นๆ จะเติมไฮโดรเจนเพื่อสร้างไซโคลเฮกเซน:

2- คลอรีนของเบนซีน
ภายใต้อิทธิพลของรังสีอัลตราไวโอเลต เบนซีนจะเติมคลอรีน หากขวดแก้วควอตซ์ที่บรรจุสารละลายคลอรีนในเบนซีนโดนแสงแดด สารละลายจะเปลี่ยนสีอย่างรวดเร็วและคลอรีนจะรวมตัวกับเบนซีนเกิดเป็น 1,2,3,4,5,6-เฮกซะคลอโรไซโคลเฮกเซน ซึ่งเรียกว่า เฮกซะคลอเรน(ก่อนหน้านี้ใช้เป็นยาฆ่าแมลง):

3. การเผาไหม้ของเบนซีน.
เบนซีนและอะโรมาติกไฮโดรคาร์บอนต่างจากอัลเคนตรงที่มีเปลวไฟสว่างและเป็นควัน
สรุปบทเรียน
ในบทเรียนนี้ คุณได้ศึกษาหัวข้อ "คุณสมบัติทางเคมีของเบนซีน" การใช้วัสดุนี้ ทำให้คุณเข้าใจคุณสมบัติทางเคมีของเบนซีน รวมถึงสภาวะที่ไม่เอื้ออำนวยที่จำเป็นสำหรับเบนซีนในการทำปฏิกิริยากับสารอื่นๆ
อ้างอิง
1. Rudzitis G.E. เคมี. ความรู้พื้นฐานทางเคมีทั่วไป ชั้นประถมศึกษาปีที่ 10: หนังสือเรียนสำหรับสถาบันการศึกษาทั่วไป: ระดับพื้นฐาน/ G.E. Rudzitis, F.G. เฟลด์แมน. - ฉบับที่ 14 - อ.: การศึกษา, 2555.
2. เคมี. ชั้นประถมศึกษาปีที่ 10 ระดับโปรไฟล์: หนังสือเรียน เพื่อการศึกษาทั่วไป สถาบัน/ วี.วี. เอเรมิน, N.E. คุซเมนโก, วี.วี. Lunin และคณะ - ม.: อีแร้ง, 2551. - 463 น.
3. เคมี. ชั้นประถมศึกษาปีที่ 11 ระดับโปรไฟล์: วิชาการ เพื่อการศึกษาทั่วไป สถาบัน/ วี.วี. เอเรมิน, N.E. คุซเมนโก, วี.วี. Lunin และคณะ - ม.: อีแร้ง, 2010. - 462 น.
4. Khomchenko G.P. , Khomchenko I.G. รวบรวมปัญหาเคมีสำหรับผู้เข้ามหาวิทยาลัย - ฉบับที่ 4 - อ.: RIA "คลื่นลูกใหม่": ผู้จัดพิมพ์ Umerenkov, 2012. - 278 หน้า
การบ้าน
1. หมายเลข 13, 14 (หน้า 62) Rudzitis G.E., Feldman F.G. เคมี: เคมีอินทรีย์ ชั้นประถมศึกษาปีที่ 10: หนังสือเรียนสำหรับสถาบันการศึกษาทั่วไป: ระดับพื้นฐาน / G. E. Rudzitis, F.G. เฟลด์แมน. - ฉบับที่ 14 - อ.: การศึกษา, 2555.
2. เหตุใดสารประกอบอะโรมาติกจึงมีคุณสมบัติทางเคมีแตกต่างจากไฮโดรคาร์บอนทั้งอิ่มตัวและไม่อิ่มตัว
3. เขียนสมการปฏิกิริยาสำหรับการเผาไหม้ของเอทิลเบนซีนและไซลีน