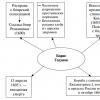
Escribe la ecuación de la reacción de combustión del benceno. Cálculo de parámetros de productos de combustión de benceno en el aire. Alquilación de hidrocarburos aromáticos.
El primer grupo de reacciones son las reacciones de sustitución. Dijimos que los arenos no tienen enlaces múltiples en la estructura de la molécula, pero contienen un sistema conjugado de seis electrones, que es muy estable y le da fuerza adicional al anillo de benceno. Por lo tanto, en las reacciones químicas, primero se produce la sustitución de los átomos de hidrógeno y no la destrucción del anillo de benceno.
Ya nos hemos encontrado con reacciones de sustitución cuando hablamos de alcanos, pero para ellos estas reacciones siguieron un mecanismo radical, mientras que los arenos se caracterizan por un mecanismo iónico de reacciones de sustitución.
Primero propiedad química halogenación. Reemplazo de un átomo de hidrógeno por un átomo de halógeno, cloro o bromo.
La reacción se produce cuando se calienta y siempre con la participación de un catalizador. En el caso del cloro, podría ser cloruro de aluminio o cloruro férrico tres. El catalizador polariza la molécula de halógeno, provocando la escisión del enlace heterolítico y produciendo iones.
El cloro es un ion cargado positivamente y reacciona con el benceno.
Si la reacción ocurre con bromo, entonces el catalizador es bromuro de hierro o bromuro de aluminio.

Es importante señalar que la reacción ocurre con bromo molecular, no con agua con bromo. El benceno no reacciona con el agua con bromo.
La halogenación de homólogos de benceno tiene sus propias características. En la molécula de tolueno, el grupo metilo facilita la sustitución en el anillo, aumenta la reactividad y la reacción ocurre en condiciones más suaves, es decir, a temperatura ambiente.

Es importante señalar que la sustitución siempre se produce en las posiciones orto y para, por lo que se obtiene una mezcla de isómeros.
Segundo propiedad de nitración del benceno, introducción de un grupo nitro en el anillo de benceno.

Se forma un líquido pesado de color amarillento con olor a almendras amargas: nitrobenceno, por lo que la reacción puede ser cualitativa con el benceno. Para la nitración se utiliza una mezcla nitrante de ácidos nítrico y sulfúrico concentrados. La reacción se lleva a cabo calentando.
Permítanme recordarles que para la nitración de alcanos en la reacción de Konovalov se utilizó ácido nítrico diluido sin la adición de ácido sulfúrico.
Durante la nitración del tolueno, así como durante la halogenación, se forma una mezcla de isómeros orto y para.

Tercero Propiedad de alquilación del benceno con haloalcanos.

Esta reacción permite la introducción de un radical hidrocarbonado en el anillo de benceno y puede considerarse un método para producir homólogos de benceno. El cloruro de aluminio se utiliza como catalizador, que promueve la descomposición de la molécula de haloalcano en iones. También es necesaria la calefacción.
Cuatro Propiedad de alquilación del benceno con alquenos.

De esta forma se puede obtener, por ejemplo, cumeno o etilbenceno. Cloruro de aluminio catalizador.
2. Reacciones de adición al benceno.
El segundo grupo de reacciones son las reacciones de adición. Dijimos que estas reacciones no son típicas, pero son posibles en condiciones bastante estrictas con la destrucción de la nube de electrones pi y la formación de enlaces seis sigma.
Quinto propiedad en la lista general hidrogenación, adición de hidrógeno.

Temperatura, presión, catalizador de níquel o platino. El tolueno puede reaccionar de la misma manera.
Sexto cloración de propiedad. Tenga en cuenta que estamos hablando específicamente de interacción con el cloro, ya que el bromo no entra en esta reacción.

La reacción se produce bajo una fuerte irradiación ultravioleta. Se forma hexaclorociclohexano, otro nombre del hexaclorano, un sólido.
Es importante recordar que para el benceno no es posible reacciones de adición de haluros de hidrógeno (hidrohalogenación) y adición de agua (hidratación).
3. Sustitución en la cadena lateral de homólogos de benceno.
El tercer grupo de reacciones afecta únicamente a los homólogos del benceno: se trata de una sustitución en la cadena lateral.
Séptimo propiedad en la lista general halogenación en el átomo de carbono alfa en la cadena lateral.

La reacción se produce cuando se calienta o se irradia y siempre sólo en el carbono alfa. A medida que continúa la halogenación, el segundo átomo de halógeno volverá a la posición alfa.
4. Oxidación de homólogos de benceno.
El cuarto grupo de reacciones es la oxidación.
El anillo de benceno es demasiado fuerte, por lo que el benceno no se oxida El permanganato de potasio no decolora su solución. Es muy importante recordar esto.
Pero los homólogos del benceno se oxidan con una solución acidificada de permanganato de potasio cuando se calientan. Y esta es la octava propiedad química.

Esto produce ácido benzoico. Se observa decoloración de la solución. En este caso, no importa cuán larga sea la cadena de carbono del sustituyente, siempre se rompe después de que el primer átomo de carbono y el átomo alfa se oxidan a un grupo carboxilo con la formación de ácido benzoico. El resto de la molécula se oxida al ácido correspondiente o, si se trata de un solo átomo de carbono, a dióxido de carbono.
Si un homólogo de benceno tiene más de un sustituyente hidrocarbonado en el anillo aromático, entonces la oxidación se produce de acuerdo con las mismas reglas: el carbono ubicado en la posición alfa se oxida.

Este ejemplo produce un ácido aromático dibásico llamado ácido ftálico.
Me gustaría destacar especialmente la oxidación del cumeno, isopropilbenceno, por el oxígeno atmosférico en presencia de ácido sulfúrico.

Este es el llamado método cumeno para producir fenol. Por regla general, esta reacción se produce en cuestiones relacionadas con la producción de fenol. Este es un método industrial.
Noveno propiedad de combustión, oxidación completa con oxígeno. El benceno y sus homólogos se queman formando dióxido de carbono y agua.
Escribamos la ecuación de combustión del benceno en forma general.
Según la ley de conservación de la masa, debería haber tantos átomos a la izquierda como átomos a la derecha. Porque en las reacciones químicas los átomos no desaparecen, sino que el orden de los enlaces entre ellos simplemente cambia. Entonces habrá tantas moléculas de dióxido de carbono como átomos de carbono en la molécula de areno, ya que la molécula contiene un átomo de carbono. Es decir, n moléculas de CO 2. Habrá dos veces menos moléculas de agua que átomos de hidrógeno, es decir (2n-6)/2, que significa n-3.
Hay la misma cantidad de átomos de oxígeno a la izquierda y a la derecha. A la derecha hay 2n del dióxido de carbono, porque cada molécula tiene dos átomos de oxígeno, más n-3 del agua, para un total de 3n-3. A la izquierda hay la misma cantidad de átomos de oxígeno 3n-3, lo que significa que hay dos veces menos moléculas, porque la molécula contiene dos átomos. Es decir (3n-3)/2 moléculas de oxígeno.
Por tanto, hemos compilado una ecuación para la combustión de homólogos de benceno en forma general.
HC aromáticos (arenas)– son hidrocarburos cuyas moléculas contienen uno o más anillos de benceno.
Ejemplos de hidrocarburos aromáticos:

Arenas de la serie del benceno (arenos monocíclicos)
Fórmula general:C norte H 2n-6 , n≥6
El representante más simple de los hidrocarburos aromáticos es el benceno, su fórmula empírica es C 6 H 6.
Estructura electrónica de la molécula de benceno.
La fórmula general de los arenos monocíclicos C n H 2 n -6 muestra que son compuestos insaturados.
En 1856, el químico alemán A.F. Kekule propuso una fórmula cíclica para el benceno con enlaces conjugados (enlaces simples y dobles alternos) - ciclohexatrieno-1,3,5: 
Esta estructura de la molécula de benceno no explica muchas de las propiedades del benceno:
- El benceno se caracteriza por reacciones de sustitución en lugar de reacciones de adición características de los compuestos insaturados. Las reacciones de suma son posibles, pero son más difíciles que para ;
- El benceno no entra en reacciones que son reacciones cualitativas con hidrocarburos insaturados (con agua de bromo y solución de KMnO 4).
Estudios posteriores de difracción de electrones demostraron que todos los enlaces entre los átomos de carbono en la molécula de benceno tienen la misma longitud de 0,140 nm (el valor promedio entre la longitud de un simple Conexiones SS 0,154 nm y doble enlace C=C 0,134 nm). El ángulo entre los enlaces en cada átomo de carbono es de 120°. La molécula es un hexágono plano regular.
La teoría moderna para explicar la estructura de la molécula C 6 H 6 utiliza la idea de hibridación de orbitales atómicos.
Los átomos de carbono del benceno se encuentran en un estado de hibridación sp 2. Cada átomo "C" forma tres enlaces σ (dos con átomos de carbono y uno con un átomo de hidrógeno). Todos los enlaces σ están en el mismo plano:
Cada átomo de carbono tiene un electrón p, que no participa en la hibridación. Los orbitales p no hibridados de los átomos de carbono están en un plano perpendicular al plano de los enlaces σ. Cada nube p se superpone con dos nubes p vecinas y, como resultado, se forma un único sistema π conjugado (recuerde el efecto de la conjugación de electrones p en la molécula de 1,3-butadieno, discutido en el tema “Hidrocarburos dienos”) ”):
La combinación de seis enlaces σ con un solo sistema π se llama conexión aromática.
Un anillo de seis átomos de carbono unidos por un enlace aromático se llama anillo de benceno o anillo de benceno.
De acuerdo con las ideas modernas sobre la estructura electrónica del benceno, la molécula C 6 H 6 se representa de la siguiente manera:

Propiedades físicas del benceno.
El benceno en condiciones normales es un líquido incoloro; t o pl = 5,5 o C; para dormir. = 80ºC; tiene un olor característico; no se mezcla con agua, buen disolvente, altamente tóxico.
Propiedades químicas del benceno.
La conexión aromática determina propiedades quimicas benceno y otros hidrocarburos aromáticos.
El sistema de 6 electrones π es más estable que los enlaces π ordinarios de dos electrones. Por tanto, las reacciones de adición son menos típicas de los hidrocarburos aromáticos que de los hidrocarburos insaturados. Las reacciones más características de los arenos son las reacciones de sustitución.
I. Reacciones de sustitución
1.Halogenación

2. Nitración
La reacción se realiza con una mezcla de ácidos (mezcla nitrante): 
3.sulfonación

4.Alquilación (reemplazo del átomo “H” por un grupo alquilo) – Reacciones de Friedel-Crafts, se forman homólogos de benceno:

En lugar de haloalcanos, se pueden utilizar alquenos (en presencia de un catalizador: AlCl 3 o ácido inorgánico):

II. Reacciones de suma
1.Hidrogenación

2.Adición de cloro

III.Reacciones de oxidación
1. Combustión
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O
2. Oxidación incompleta (KMnO 4 o K 2 Cr 2 O 7 en un ambiente ácido). El anillo de benceno es resistente a los agentes oxidantes. No se produce ninguna reacción.
Obtención de benceno
En la industria:
1) procesamiento de petróleo y carbón;
2) deshidrogenación de ciclohexano:

3) deshidrociclación (aromatización) de hexano:

En el laboratorio:
Fusión de sales de ácido benzoico con:

Isomería y nomenclatura de homólogos de benceno.
Cualquier homólogo de benceno tiene una cadena lateral, es decir. Radicales alquilo unidos a un anillo de benceno. El primer homólogo de benceno es un anillo de benceno unido a un radical metilo: 
El tolueno no tiene isómeros, ya que todas las posiciones en el anillo de benceno son equivalentes.
Para los homólogos posteriores del benceno, es posible un tipo de isomería: la isomería de cadena lateral, que puede ser de dos tipos:
1) isomería del número y estructura de sustituyentes;
2) isomería de la posición de los sustituyentes.



Propiedades físicas del tolueno
tolueno- un líquido incoloro de olor característico, insoluble en agua, soluble en disolventes orgánicos. El tolueno es menos tóxico que el benceno.
Propiedades químicas del tolueno.
I. Reacciones de sustitución
1.Reacciones que involucran el anillo de benceno.
El metilbenceno participa en todas las reacciones de sustitución en las que participa el benceno y, al mismo tiempo, muestra una mayor reactividad, las reacciones avanzan a mayor velocidad.
El radical metilo contenido en la molécula de tolueno es un sustituyente de este tipo, por lo que como resultado de reacciones de sustitución en el anillo de benceno se obtienen derivados orto y para del tolueno o, en caso de exceso del reactivo, triderivados. de la fórmula general:

a) halogenación


Con cloración adicional, se pueden obtener diclorometilbenceno y triclorometilbenceno:

II. Reacciones de suma
Hidrogenación

III.Reacciones de oxidación
1.Combustión
C6H5CH3 + 9O2 → 7CO2 + 4H2O
2. Oxidación incompleta
A diferencia del benceno, sus homólogos son oxidados por ciertos agentes oxidantes; en este caso, la cadena lateral está sujeta a oxidación, en el caso del tolueno, el grupo metilo. Los agentes oxidantes suaves como el MnO 2 lo oxidan a un grupo aldehído, los agentes oxidantes más fuertes (KMnO 4) provocan una mayor oxidación a un ácido: 
Cualquier homólogo de benceno con una cadena lateral se oxida mediante un agente oxidante fuerte como el KMnO4 en ácido benzoico, es decir, la cadena lateral se rompe con oxidación de la parte escindida a CO2; Por ejemplo: 
Si hay varias cadenas laterales, cada una de ellas se oxida a un grupo carboxilo y como resultado se forman ácidos polibásicos, por ejemplo:

Obtención de tolueno:
En la industria:
1) procesamiento de petróleo y carbón;
2) deshidrogenación de metilciclohexano:

3) deshidrociclización del heptano:
En el laboratorio:
1) alquilación de Friedel-Crafts;
2) Reacción de Wurtz-Fittig(reacción de sodio con una mezcla de halobenceno y haloalcano).
Arenas (hidrocarburos aromáticos) – Se trata de hidrocarburos cíclicos insaturados (insaturados), cuyas moléculas contienen grupos de átomos cíclicos estables (núcleos de benceno) con un sistema cerrado de enlaces conjugados.
Fórmula general: C n H 2n–6para norte ≥ 6.
Propiedades químicas de los arenos.
Estadios– hidrocarburos insaturados, cuyas moléculas contienen tres dobles enlaces y un anillo. Pero debido al efecto de conjugación, las propiedades de los arenos difieren de las propiedades de otros hidrocarburos insaturados.
Los hidrocarburos aromáticos se caracterizan por las siguientes reacciones:
- adhesiones,
- sustituciones,
- oxidación (para homólogos de benceno).
El sistema aromático del benceno es resistente a los agentes oxidantes. Sin embargo, los homólogos del benceno se oxidan con permanganato de potasio y otros agentes oxidantes.
1. Reacciones de suma
El benceno agrega cloro a la luz e hidrógeno cuando se calienta en presencia de un catalizador.
1.1. Hidrogenación
El benceno añade hidrógeno cuando se calienta y bajo presión en presencia de catalizadores metálicos (Ni, Pt, etc.).
Cuando se hidrogena el benceno, se forma ciclohexano:
Cuando se hidrogenan homólogos, se forman derivados de cicloalcano. Cuando se calienta tolueno con hidrógeno bajo presión y en presencia de un catalizador, se forma metilciclohexano:
1.2. Cloración de arenas
Se produce la adición de cloro al benceno. por un mecanismo radical con temperatura alta , bajo la influencia de la radiación ultravioleta.
Cuando el benceno se clora con la luz, se forma 1,2,3,4,5,6-hexaclorociclohexano (hexaclorano).
El hexaclorano es un pesticida que se utiliza para controlar insectos dañinos. Actualmente está prohibido el uso de hexaclorano.
Los homólogos del benceno no añaden cloro. Si un homólogo de benceno reacciona con cloro o bromo a la luz o a alta temperatura (300°C), luego se reemplazan los átomos de hidrógeno en el sustituyente alquilo colgante en lugar de en el anillo aromático.
2. Reacciones de sustitución
2.1. Halogenación
El benceno y sus homólogos entran en reacciones de sustitución con halógenos (cloro, bromo) en presencia de catalizadores (AlCl 3, FeBr 3) .
Al interactuar con el cloro en el catalizador AlCl 3, se forma clorobenceno:
Los hidrocarburos aromáticos reaccionan con el bromo cuando se calientan y en presencia de un catalizador: FeBr 3. El hierro metálico también se puede utilizar como catalizador.
El bromo reacciona con el hierro para formar bromuro de hierro (III), que cataliza la bromación del benceno:
Meta-El clorotolueno se forma en pequeñas cantidades.
Cuando los homólogos del benceno interactúan con halógenos a la luz o a altas temperaturas(300 o C) el hidrógeno no se reemplaza en el anillo de benceno, sino en el radical hidrocarbonado lateral.
Por ejemplo, al clorar etilbenceno:
2.2. Nitración
El benceno reacciona con ácido nítrico concentrado en presencia de ácido sulfúrico concentrado (mezcla nitrante).
Esto produce nitrobenceno:
El tolueno reacciona con ácido nítrico concentrado en presencia de ácido sulfúrico concentrado.
En los productos de reacción indicamos oh-nitrotolueno:
o norte-nitrotolueno:
La nitración del tolueno también puede ocurrir con la sustitución de tres átomos de hidrógeno. Esto produce 2,4,6-trinitrotolueno (TNT, tol):
2.3. Alquilación de hidrocarburos aromáticos.
- Los arenos reaccionan con haloalcanos en presencia de catalizadores (AlCl 3, FeBr 3, etc.) para formar homólogos de benceno.
- Los hidrocarburos aromáticos reaccionan con los alquenos en presencia de cloruro de aluminio, bromuro de hierro (III), ácido fosfórico, etc.
- La alquilación con alcoholes se produce en presencia de ácido sulfúrico concentrado.
2.4. Sulfonación de hidrocarburos aromáticos.
El benceno reacciona cuando se calienta con ácido sulfúrico concentrado o una solución de SO 3 en ácido sulfúrico (oleum) para formar ácido bencenosulfónico:
3. Oxidación de arenos
El benceno es resistente incluso a agentes oxidantes fuertes. Pero los homólogos del benceno se oxidan bajo la influencia de agentes oxidantes fuertes. El benceno y sus homólogos arden.
3.1. Oxidación completa - combustión
Cuando el benceno y sus homólogos se queman, se forman dióxido de carbono y agua. La reacción de combustión de los arenos va acompañada de la liberación de una gran cantidad de calor.
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O + Q
La ecuación de combustión de arenos en forma general:
C norte H 2n–6 + (3n – 3)/2 O 2 → nCO 2 + (n – 3)H 2 O + q
Cuando los hidrocarburos aromáticos se queman por falta de oxígeno, se puede formar monóxido de carbono CO u hollín C.
El benceno y sus homólogos arden en el aire con una llama humeante. El benceno y sus homólogos forman mezclas explosivas con el aire y el oxígeno.
3.2. ACERCA DEoxidación de homólogos de benceno
Los homólogos del benceno se oxidan fácilmente con permanganato y dicromato de potasio en un ambiente ácido o neutro cuando se calientan.
esto sucede Oxidación de todos los enlaces en un átomo de carbono., adyacente al anillo de benceno, excepto por el enlace de este átomo de carbono con el anillo de benceno.
El tolueno se oxida permanganato de potasio en ácido sulfúrico con educación ácido benzoico:
Si se produce oxidación del tolueno en una solución neutra cuando se calienta, entonces se forma sal de ácido benzoico - benzoato de potasio:
Así, el tolueno decolora una solución acidificada de permanganato de potasio cuando se calienta.
Los radicales más largos se oxidan a ácido benzoico y ácido carboxílico:
La oxidación del propilbenceno produce ácidos benzoico y acético:
El permanganato de potasio oxida el isopropilbenceno en un ambiente ácido a ácido benzoico y dióxido de carbono:
4. Efecto de orientación de los sustituyentes en el anillo de benceno.
Si el anillo de benceno contiene sustituyentes, no solo alquilo, sino también otros átomos (hidroxilo, grupo amino, grupo nitro, etc.), entonces las reacciones de sustitución de átomos de hidrógeno en el sistema aromático se desarrollan de una manera estrictamente definida, de acuerdo con la naturaleza influencia del sustituyente en el sistema π aromático.
Tipos de sustituyentes en el anillo de benceno.
| Sustituyentes del primer tipo. | Sustituyentes del segundo tipo. |
| orto- Y par-posición | La sustitución adicional se produce principalmente en meta-posición |
| Donante de electrones, aumenta la densidad de electrones en el anillo de benceno. | Al ser atractores de electrones, reducen la densidad electrónica en el sistema conjugado. |
|
|
Presentamos a su atención una videolección dedicada al tema “Propiedades químicas del benceno”. Con este vídeo, podrá comprender las propiedades químicas del benceno, así como las duras condiciones necesarias para que el benceno reaccione con otras sustancias.
Sujeto:Hidrocarburos aromáticos
Lección:Propiedades químicas del benceno.
Arroz. 1. Molécula de benceno
Es difícil romper la nube de electrones p en una molécula de benceno. Por lo tanto, el benceno participa en reacciones químicas de manera mucho menos activa en comparación con los compuestos insaturados.


Para que el benceno entre en reacciones químicas, se requieren condiciones bastante estrictas: temperatura elevada y, en muchos casos, un catalizador. En la mayoría de las reacciones, se retiene el anillo de benceno estable.
1. Brominación.

Se requiere un catalizador (bromuro de hierro (III) o aluminio) y no se permiten ni siquiera pequeñas cantidades de agua. La función del catalizador es que la molécula de bromo es atraída por uno de los átomos de bromo hacia el átomo de hierro. Como resultado, está polarizado: un par de electrones de enlace van al átomo de bromo asociado con el hierro:
Hermano +…. Br - FeBr 3 .
Br+ es un electrófilo fuerte. Es atraído por la nube de seis electrones del anillo de benceno y la rompe, formando un enlace covalente con el átomo de carbono:
Un anión bromo podría unirse al catión resultante. Pero la reducción del sistema aromático del anillo de benceno es energéticamente más favorable que la adición del anión bromo. Por lo tanto, la molécula entra en un estado estable, expulsando un ion de hidrógeno:
Todas las reacciones de sustitución electrófila en el anillo de benceno se desarrollan mediante un mecanismo similar.
2. Nitración

El benceno y sus homólogos reaccionan con una mezcla de ácidos sulfúrico y nítrico concentrados (mezcla nitrante). En la mezcla nitrante existe en equilibrio el ion nitronio NO 2 +, que es un electrófilo:

3. Sulfonación.
El benceno y otros arenos, cuando se calientan, reaccionan con ácido sulfúrico concentrado o óleum, una solución de SO 3 en ácido sulfúrico:

4 . Alquilación de Friedel-Crafts
5. Alquilación con alquenos

Estas reacciones son energéticamente desfavorables y, por lo tanto, sólo ocurren cuando se calientan o se irradian.
1. Hidrogenación.
Cuando se calientan, a presión elevada y en presencia de un catalizador de Ni, Pt o Pd, el benceno y otros arenos añaden hidrógeno para formar ciclohexano:

2. Cloración del benceno.
Bajo la influencia de la radiación ultravioleta, el benceno añade cloro. Si un matraz de vidrio de cuarzo que contiene una solución de cloro en benceno se expone a la luz solar, la solución rápidamente se decolorará y el cloro se combinará con el benceno para formar 1,2,3,4,5,6-hexaclorociclohexano, conocido como hexaclorano(anteriormente utilizado como insecticida):

3. combustión de benceno.
A diferencia de los alcanos, el benceno y otros hidrocarburos aromáticos tienen una llama brillante y humeante.
Resumiendo la lección
En esta lección estudiaste el tema "Propiedades químicas del benceno". Con este material, pudo comprender las propiedades químicas del benceno, así como las duras condiciones necesarias para que el benceno reaccione con otras sustancias.
Referencias
1. Rudzitis G.E. Química. Fundamentos de química general. Décimo grado: libro de texto para instituciones de educación general: nivel básico/ G. E. Rudzitis, F. G. Feldman. - 14ª edición. - M.: Educación, 2012.
2. Química. Décimo grado. Nivel de perfil: libro de texto para educación general instituciones/ V.V. Eremin, N.E. Kuzmenko, V.V. Lunin et al. - M.: Avutarda, 2008. - 463 p.
3. Química. 11º grado. Nivel de perfil: académico. para educación general instituciones/ V.V. Eremin, N.E. Kuzmenko, V.V. Lunin et al. - M.: Avutarda, 2010. - 462 p.
4. Khomchenko G.P., Khomchenko I.G. Colección de problemas de química para quienes ingresan a las universidades. - 4ª ed. - M.: RIA "Nueva Ola": Editorial Umerenkov, 2012. - 278 p.
Tarea
1. Nos. 13, 14 (p. 62) Rudzitis G.E., Feldman F.G. Química: Química orgánica. Décimo grado: libro de texto para instituciones de educación general: nivel básico / G. E. Rudzitis, F.G. Feldman. - 14ª edición. - M.: Educación, 2012.
2. ¿Por qué los compuestos aromáticos difieren en propiedades químicas de los hidrocarburos saturados e insaturados?
3. Escribe las ecuaciones de reacción para la combustión de etilbenceno y xileno.